某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
I、探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。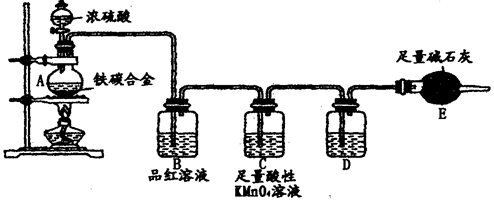
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B容器中均无明显现象,其原因是:___________________________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式________________、____________________。
(4)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_________________________________________________。
Ⅱ、测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。则铁碳合金中铁的质量分数为_________________________(用含m、b的表达式表示)。
(6)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是_________________。
(7)乙同学认为,即使甲同学认为的偏差得到改进,依据此实
验测得合金中铁的质量分数也可能会偏高。你认为其中的原因
是__________________。
(8)某同学认为上述方法较复杂,使用下图所示的装置和其他
常用实验仪器测定某些数据即可。为了快速准确的计算出铁的
质量分数,最简便的实验操作是_____________(填写代号)。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量
现有三种物质A、B、C,其中有一种是酸,一种是碱,一种是盐,溶于水后电离,可以产生下表中的离子:
| 阳离子 |
Na+ H+ Ba2+ |
| 阴离子 |
OH- CO SO SO |
为鉴别它们,分别完成以下实验,其结果如下:
① A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
② B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1) 物质A溶于水的电离方程式为_________________________________。
(2) 写出下列反应的离子方程式:
A溶液与C溶液反应:____________________________________________;
B与C反应至溶液呈中性:__________________________________________。
(3) 鉴别B溶液中阴离子的实验方法是。
(4) D与E的混合物a g,加入足量盐酸,反应完全生成标准状况时的气体b L,则D在混合物中的质量分数为。
(16分)如图所示三套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀,表明铁被________(填“氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应式为_______________________。
(2)装置2中的石墨是________极(填“正”或“负”),该装置发生的总反应的离子方程式为_________________。
(3) 装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为________极;甲烧杯中铁电极的电极反应式为_________________。
②乙烧杯中电解反应的离子方程式为_________________________________。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体标准状况下的体积为________mL。
(8分)
痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
① HUr(尿酸,aq)  Ur―(尿酸根,aq)+H+(aq)(37℃时,Ka =4.0×10-6)
Ur―(尿酸根,aq)+H+(aq)(37℃时,Ka =4.0×10-6)
② NaUr(s)  Ur―(aq)+Na+(aq)
Ur―(aq)+Na+(aq)
(1)37℃时,1.0L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/L,该病人尿液的c(H+)为mol/L。
(10分)
(1)常温下,0.1 mol/L的甲酸和0.1 mol/L的盐酸各100 mL,分别与足量的同浓度氢氧化钾溶液反应所需氢氧化钾溶液的体积前者__________后者(选填“>”、“<”或“=”)。
(2)常温下,0.1 mol/L的甲酸和pH=1的甲酸各100 mL,分别与足量的碳酸氢钠溶液反应,产生的气体前者比后者__________(选填“多”、“少”或“=”)。
(3)在25 ℃条件下,将pH=10的偏铝酸钠溶液稀释100倍,稀释后溶液的pH为(填选项字母,下同)__ ___。
A.10B.8 C.10~12之间 D.8~10之间
(4) 25 ℃时,向0.1 mol/L的甲酸溶液中加入少量甲酸钠晶体,当晶体溶解后测得溶液pH将____。
A.增大B.减小 C.不变 D.无法确定
(5) 室温下,向0.1 mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又不影响H2的体积,可以向硫酸溶液中加入__________试剂。
A.硫化钠晶体 B.甲酸钠晶体 C.少量银粉 D.硫酸钠溶液
(12分)
25℃时,三种酸的电离常数为:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数K |
1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
请回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:________(填编号)
(2)常温下0.1 mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=________,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)D.c(OH-)/c(H+)
(3) 体积为10 mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000 mL,稀释过程pH变化如图;则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”)。
(4) 25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=_______mol/L(填准确数值)。