如右图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜,一段时间后停止通电,A池D极产生的气体在标准状况下为2.24 L。下列说法正确的是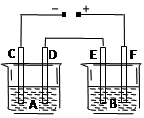
| A.A池为电解池,B池为原电池 |
| B.D电极与E电极都发生氧化反应 |
| C.F极是以粗铜板为材料作阳极 |
| D.B池中E极质量增加12.8 g |
1 L某溶液中含有的离子如下表:
| 离子 |
Cu2+ |
Al3+ |
NO |
Cl- |
| 物质的量浓度(mol/L) |
1 |
1 |
a |
1 |
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
A.a=3B.电解后溶液的c(H+)=1mol·L-1
C.电解该溶液相当于只电解CuCl2溶液D.阴极析出的金属是铜与铝
T℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
A.T℃时,该反应的化学方程式为:X(g)+Y(g) 2Z(g),平衡常数K=4 2Z(g),平衡常数K=4 |
| B.平衡时X、Y的转化率相同 |
| C.达到平衡后,恒温将容器体积扩大为3 L,平衡向逆反应方向移动 |
| D.T ℃时,若起始时X为0.60mol,Y为1.00 mol,则平衡时Y的 |
转化率小于80%
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液,下列说法中正确的是
| A.放电时K+移向负极 |
| B.放电时电池负极的电极反应为H2-2e-===2H+ |
| C.放电时电池正极的电极反应为NiO(OH)+H2O+e-===Ni(OH)2+OH- |
| D.该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
下图为一原电池装置,下列叙述中正确的是
| A.该装置中电子由Zn极流向Cu极,溶液中的SO42-通过盐桥移向Zn极 |
| B.将上述装置中的Zn棒和Cu棒同时浸入CuSO4溶液,电流计的指针偏转幅度变小,且很快减弱 |
| C.将烧杯内溶液对换,电流计指针也能发生偏转 |
| D.将盐桥改为铜导线连接两种溶液,电流由Cu极移向Zn极 |
高温下,某反应达平衡,平衡常数 恒容时,温度升高,H2浓度减小。下列说法正确的是
恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.温度升高时,K值减小 | B.恒温恒容下,增大压强,H2浓度可能增大、减小或不变 |
| C.升高温度,逆反应速率减小 | D.该反应化学方程式为:CO(g)+3H2(g) CH4 (g)+H2O(g) CH4 (g)+H2O(g) |