在有机化合物中,由于基团之间的相互影响,会使有机物分子中相关原子或原子团的反应活性发生显著的变化。
①实验表明,丙酸CH3CH2COOH分子中“—CH2—”上的碳氢键因与“—COOH”相邻,
反应活性明显增强,比如,在红磷存在时,丙酸可与液溴反应生成2—溴丙酸
(CH3CHBrCOOH)。
②已知含有“—C C C—”结构的有机物不能稳定存在。请结合①②有关信息,分析如下转化关系,图中所用NaOH都是足量的,回答问题:
(1)A的结构简式为 ;图中A所发生的反应类型是 ; F中所含官能团的名称是 。
(2)C→D的化学方程式为 。
(3)D不可能发生的反应是 (填字母代号)。
a. 水解反应 b. 消去反应 c. 中和反应 d. 酯化反应 e.氧化反应
(4)F有多种同分异构体,其中含有—C≡C—且属于甲羧酯类的有机物共有 种,写出其中在核磁共振氢谱中有四个吸收峰的结构简式 。
现有如下两个反应:
(A)NaOH + HCl =" NaCl" + H2O(B)2FeCl3 + Cu = 2FeCl2 + CuCl2,
根据两反应本质,判断能否设计成原电池(A)(B)。
能源是影响全球经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是最理想的清洁能源之一。已知反应:2H2+O2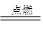 2H2O,试回答下列问题。
2H2O,试回答下列问题。
(1)该反应为反应(填“吸热”或“放热”);
(2) 1当生成8g H2O时,H2O的物质的量是(填字母代号)。
A.1mol B.1mol/LC.1g/mol
卤族元素包括______、______、______ 、______(填元素符号),随核电荷数递增,它们的原子半径依次_____________,单质的氧化性依次___________________。
在铜锌原电池中,以硫酸铜溶液为电解质溶液;
锌为极,电极上发生的是________反应(“氧化”或“还原”),电极反应式为____ ______,锌片表面可观察到的现象是:__________;铜为__ ___极,电极上发生的是__ ______反应(“氧化”或“还原”),电极反应式是___ _ ______,铜表面上可观察到的现象是:_ _________;
对于反应2SO2(g)+O2(g)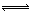 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
降低温度 |
|
| ② |
加入氮气 |
|
| ③ |
用催化剂 |
|
| ④ |
压缩体积 |