(共10分)请按要求回答下列问题:
(1)硅在无机非金属材料中一直扮演着重要角色,被誉为无机非金属材料的主角。
①下列物品用到硅单质的是;
| A.玻璃制品 | B.石英钟表 | C.计算机芯片 | D.光导纤维 E.太阳能电池 |
②硅酸盐组成复杂,往往用氧化物的形式表示,某硅酸盐其主要化学成分为Ca2Mg5Si8O22(OH)2. 把它写成氧化物的形式为:;
(2)Cl2和SO2都具有漂白性,但将这两种气体按体积比1:1通入水中得到的溶液却几乎没有漂白性,写出Cl2和SO2 1:1通入水中发生的离子反应方程式:______________________________________________________;
(3)写出二氧化硫与双氧水反应的化学方程式,并标出电子转移方向和数目: ______________________。
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应如下:
KMnO4 + HCl(浓) → KCl + MnCl2 + Cl2↑ + H2O
(1)配平反应方程式:
KMnO4 +HCl(浓) →KCl + MnCl2 + Cl2↑ +H2O
(2)当有0.2mol电子发生转移时,生成氯气的体积(标准状况)L,被氧化的氯化氢的物质的量为 mol。该反应中HCl体现了性和性。
mol。该反应中HCl体现了性和性。
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如表所示。回答下列问题:
(1)图中“试剂1”为 。
。
(2)加入CuO作用是调节溶液pH,则pH的范围为。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通人饱和食盐水中。其中,应先通入气体是(填代号及对应物质的化学式)
(4)由溶液C获得CuCl2·3H2O,需要经过、、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+反应平衡常数。
Cu(OH)2+2H+反应平衡常数。
T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体)。
回答下列问题:
(1)写出该反应的 化学方程式
化学方程式
(2)反应开始至3 min时,用D表示的平均反应速率为mol·L-1·min-1。
(3)T℃时,该反应的化学平衡常数K=。
(4)第6min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为。
(5)另有一个2L的密闭容器,T℃、某一时刻时,容器中各物质的量如下表所示: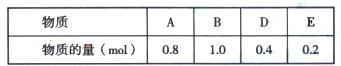
此时v(正)v(逆)(填“大于”或“等于”或“小于”)。
Q、W、X、Y、Z是原子序数逐渐增大的短周期元素。已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数 是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。(注:答题应根据题目要求,用元素符号或化学式来表示对应元素或物质)
是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物。(注:答题应根据题目要求,用元素符号或化学式来表示对应元素或物质)
(1)Z的离子结构示意图
(2)为了提高工业合成XQ 3产率(该反应为放热反应),下列措施合理的是
3产率(该反应为放热反应),下列措施合理的是
a.升高温度
b.加 入催化剂
入催化剂
c.将XQ3分离出去
d.增大反应体系压强
(3)WQ4与Y2反应通过下图装置可将化学能转化为电能。b电极反应式为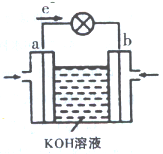
(4)标况下2.24LWY2被200mL 1 mol/LZYQ溶液吸收,所得溶液阴离子浓度从大到小的顺序是
(5)下图为某反应体系各物质(均为气体)的量及能量关系,该反应的热化学方程式为。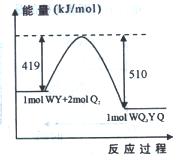
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,其化学方程式是。