A、B、R、D、E、F是六种原子序数依次增大的短周期元素, 其中有两种非金属元素位于同一主族。已知A、B、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)仅由上述信息就可以确定的元素(写出代号与元素符号)是________________,若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)______ ______
(2) A与B、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol,则其燃烧的热化学方程式___________ _________
(3) 上述六种元素间能形成多种常见二元化合物,其中存在两类化学键的物质的电子式为_____ __(写一种即可)
(4) R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,下列有关R4的说法中正确的是__ _____
①R4与R3、R2互为同位素 ②R4不能与A、B、D的单质反应
③R4中各原子最外电子层均为8电子结构 ④R4是一种新型化合物
在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图)。随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭。
(1)该实验说明溶液的导电性与_________________有关。
(2)上述反应的离子方程式为_________________________________________。
(3)可以利用上述原理进行溶液浓度的测定。若烧杯中装有75mL 0.1mol/L Ba(OH)2溶液,当滴入25mL H2SO4时,电灯完全熄灭。试求该硫酸溶液的物质的量浓度。
(4)若用98%、1.84g/mL的浓硫酸配制上述浓度的硫酸溶液2500mL,需要多少毫升的浓硫酸(精确到0.1mL)。
请将5种物质:N2O、FeCl2、Fe (NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)_________+__________→__________+__________+__________+H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为___________。
ⅰ已知A是气态烃,完全燃烧时产生的CO2和H2O 的物质的量之比为1:1,A的相对分子质量小于30,在下图变化中,F为高分子化合物,C中含有-CHO,E有水果的香味(反应条件未写出)
(1)B中所含官能团名称 ,E 物质的名称;
(2)反应①类型为。
(3)写出下列反应的化学方程式(注明反应条件)
①;
② ;
③ ;
ⅱ一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为 g.
ⅲ某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(乙醛易溶于水),图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白: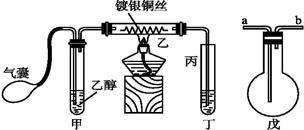
(1)甲装置常常浸在70~80 ℃的水浴中,目的是。
(2)由于装置设计上的缺陷,实验进行时可能会。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):
乙接、接丙。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
零 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
(1)在这些元素中,化学性质最不活泼的是:(填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,碱性最强的化合物的电子
式是:。
(3)①、②、③、⑤四种元素中在常温常压下的液态或气态氢化物的稳定性由大到小的顺序是。(填氢化物的分子式)
(4)①与③形成的三原子分子属于(填电解质或非电解质),它的结构式是___________,
其晶体类型为____________ 。⑥与④形成化合物的电子式是,其晶体类型为_。
(5)④元素某氧化物与①元素某氧化物反应生成单质③的化学方程式是__________________________;
若有标况下22.4L单质B生成,电子转移的数目为。
某化学兴趣小组模拟工业上从铝土矿(主要成分是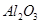 ,含
,含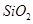 、
、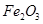 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: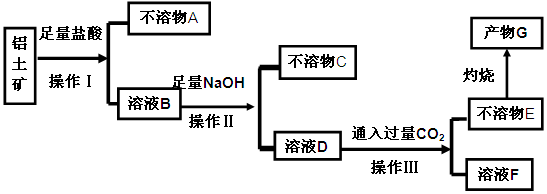
请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为。
(2)验证溶液B中是否含有Fe3+的方法:。
(3)不溶物A是(填化学式),写出D→E反应的离子方程式。
(4)说出溶液F中含碳元素溶质的一种用途。