对-甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体,某兴趣小组利用中学的简单有机物进行合成,其方案如下: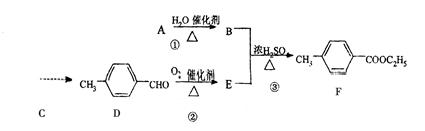
(1)A的结构简式是 ,E中含有的官能团名称是 。
(2)指出化学反应类型:① ;② 。
(3)丁子香酚(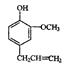 )是一种重要的调味剂,它与F的关系是 。
)是一种重要的调味剂,它与F的关系是 。
a.同系物 b.同分异构体 c.同种物质
(4)下列物质不能与丁子香酚发生反应的是 。
a.NaOH溶液 b.NaHCO3溶液 c.Br2的四氯化碳溶液 d.乙醇
(5)写出反应③的化学方程式: 。
水的电离平衡曲线如下图所示。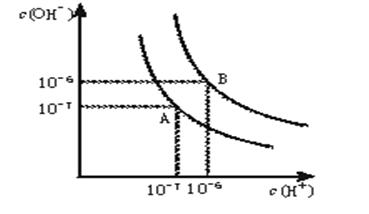
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为。
(填化学式)在空气中:将氯化铁溶液蒸干并灼烧得到的固体物质_______________;碳酸氢钠溶液蒸干并灼烧得到的固体物质_____________;硫酸铝溶液蒸干得到的固体物质___________________;亚硫酸钠溶液蒸干得到的固体物质__________。
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-、SiO32-中的
若干种组成(不考虑水的电离)。取该溶液进行如下实验:
Ⅰ.取适量溶液,加入过量的盐酸,有气体生成,并得到无色溶液;
Ⅱ.在Ⅰ所得溶液中加入过量的NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
Ⅲ. 在Ⅱ所得溶液中加入过量的Ba(OH)2溶液,加热,也有气体生成,同时析出白色沉淀乙。
请回答下列问题:
(1)由实验Ⅰ可知原溶液中一定不含有的离子是;
一定含有的离子是。
(2)由实验Ⅱ可知原溶液溶液中还一定含有的离子是;生成甲的离子方程式为。
(3)实验Ⅲ中生成白色沉淀乙的离子方程式为
。
原溶液中还可能存在的离子是;检验该离子的方法是。
已知A、B、C、D、E、F、G为七种短周期的主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。根据以上信息回答下列问题:
(1)B、C、G的氢化物中稳定性最强的是(填化学式),G的某种氧化物能使溴水褪色,写出该反应的化学方程式。
(2)B、C、D、E、F形成的简单离子半径由大到小的顺序为(用离子符号表示)。
(3)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是。
(4)碳酸盐DACO3溶液与稀硫酸混合,当生成11.2L(标准状况)气体(不考虑气体溶解)时放热6.32kJ,写出该反应的热化学离子方程式。
(5)美国国家科学院(NationalAcademyofSciences)正式发表了题为《行星系统中有机生命的限制》的研究报告。报告称,在温度、压力、物质基础以及能源供给方式都与地球迥异的地外行星上,如果存在生命,它们完全没有必要以地球生命的形式存在。有学者提出,在大气中充满B元素单质并含有丰富的A的化合物的星球上可能存在“B基生命”而不是“碳基生命”。科学家猜想这样的星球上可能会存在着一种组成结构与BA3、B2A4类似的系列化合物如B3A5、B4A6等。该系列化合物的通式为(用元素符号表示)。有B2A 4与另外两种等物质的量的该系列中的化合物组成的混合蒸气,在足量氧气中充分燃烧,只生成B元素的单质和水,且B元素的单质和水的物质的量之比为1:2,则另外两种化合物是(写化学式)。
恒温下,将a mol N2与b mol H2的混合气体通入一定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 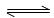 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,
计算a=。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的百分含量(体积分数)为25%。计算:平衡时NH3的物质的量为。
(3)原混合气体与平衡混合气体的总物质的量之比
n(始): n(平)=。
(4)原混合气体中a : b=。
(5)达到平衡时,N2和H2的转化率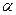 (N2):
(N2): 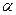 (H2)=。
(H2)=。
(6)平衡混合气体中n(N2): n(H2): n(NH3)=。