I、关于As的反应中,反应物与生成 物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
①已知KBrO3在反应中得到电子,则该反应的还原剂是 。
②已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为 。
③根据上述反应可推知  。(填序号)
。(填序号)
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4> KBrO3 KBrO3 |
| C.还原性:AsH3>X | D.还原性:X>AsH3 |
④在该反应中,氧化剂与还原剂的物质的量之比为 。
Ⅱ、X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)M在元素周期表中的位置为 。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 (写化学式)。
(3)原子序数比Y多2的元素的一种氢化 物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)写出Z的最高价氧化物对应的水化物与单质W反应的离子方程式为 
。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是 。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应: +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是 (填序号)。
某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是
Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+)。
| 氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
Cr(OH)3 |
| pH |
3.7 |
11.1 |
8 |
9(>9溶液) |
部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见上表。
(1)酸浸时,为了提高浸取率可采取的措施为________________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+,下同)。
(3)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是________。
(4)试配平反应方程式:
 ;
;
生成1 mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,
以下是以硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁αFe2O3)的生产流程示意图: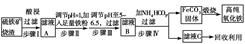
(1)步骤Ⅰ中过滤所得滤渣的主要成分是________。
(2)步骤Ⅱ中加入铁粉的目的是________。
(3)步骤Ⅲ中可选用________调节溶液的pH。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
(4)写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式:_______________________。
(5)从滤液C中回收的主要物质的一种用途是_________________________________。
现有A、B、C、D、E、F六种常见化合物,已知它们包含的阳离子有K+、Ag+、Na+、
Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、AlO2-、NO3-、SO42-、CO32-。将它们分别配成0.1 mol/L的溶液进行如下实验:
①测得溶液A、C、E均呈碱性,且碱性A>E>C,E的焰色呈浅紫色(透过蓝色钴玻璃观察);②向B溶液中滴加稀氨水至过量,先生成沉淀,后沉淀全部溶解;③向F溶液中滴加稀硝酸,溶液变成棕黄色,且有无色气体生成;④向D溶液中滴加Ba(NO3)2溶液无明显现象。
(1)写出A、D、E、F的化学式:
A________;D________;E________;F________。
(2)用离子方程式解释C溶液呈碱性的原因:__________________________________。
(3)写出实验③中反应的离子方程式:________________________________。
(1)等物质的量的下列化合物与足量浓盐酸反应,得到氯气的物质的量最多的是
________(填序号)。
已知:MnO4-+H++Cl-―→Mn2++Cl2↑+H2O(未配平)
ClO3-+H++Cl-―→Cl2↑+H2O(未配平)
ClO-+H++Cl-―→Cl2↑+H2O(未配平)
A.KClO3 B.KMnO4C.MnO2D.Ca(ClO)2
(2)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是________(填序号)。
A.3Cl2+6FeI2=2FeCl3+4FeI3
B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
D.2Fe3++2I-=2Fe2++I2
如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油。
资料一 石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态。
资料二 石油催化裂化中通常使用Al2O3作催化剂。
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图:实验过程中可观察到烧瓶中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味。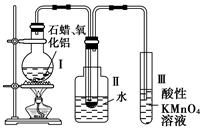
(1)该装置仪器连接的顺序应遵循的原则为__________________,
为保证实验成功,实验前必须进行的操作是_________________,
装置中较长导管的作用是_____________________。
(2)试管Ⅱ中少量液体凝结说明了______。
(3)试管Ⅲ中溶液褪色说明了________________。
(4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是_______________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式________________。
(6)石油裂化的重要意义是_____________。