同温同压同体积的CO和CO2气体所含分子数之比为 ,所含氧原子数之比为 。
(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。 
该反应过程中,被氧化与被还原的元素的物质的量之比为。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2+6H2O ="4" Al(OH)3。电池正极的电极反应式是;消耗13.5 g Al时转移_________mole-。
(3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。
已知:4Al(s) +3O2(g) = 2Al2O3(s)△H = -2830 kJ/mol △H = +230 kJ/mol
△H = +230 kJ/mol
C(s)+O2(g) = CO2(g)△H = -390 kJ/mol
铝与氧化铁发生铝热反应的热化学方程式是,铝热反应属于______(填字母)反应。
a.氧化还原 b.复分解 c.置换
烃A有如图的转化关系: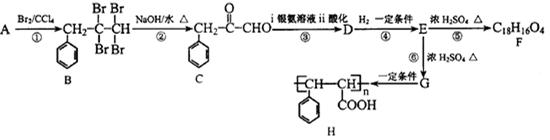
(1)物质C的分子式为____________.物质A的结构简式为_________________,
⑥的反应类型为__________,H中含氧官能团的名称为___________________.
(2)D的核磁共振氢谱图中会出现____________组吸收峰。
(3)写出E-F的化学反应方程式__________________。
(4)G的同分异构体中能同时满足如下条件:
①苯环上只有三个取代基,含有碳碳双键。
②能发生银镜反应,遇氯化铁溶液显紫色。
G共有____种同分异构体(不考虑立体异构),写出其中一种的结构简式____。
铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素。
(1)铁、钴、镍都是很好的配位化合物形成体。
① 在过量氨水中易转化为
在过量氨水中易转化为 。写出
。写出 的价层电子排布图____。
的价层电子排布图____。 中
中 的配位数为____:NH3分子的中心原子杂化方式为____。
的配位数为____:NH3分子的中心原子杂化方式为____。
H2O分子的立体构型为__________。
②铁、镍易与一氧化碳作用形成羰基配合物,如: 等。CO与N2属于等电子体,则CO分子中
等。CO与N2属于等电子体,则CO分子中 键和
键和 键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
(2)+2价和+3价是Fe、Co、Ni等元素常见化合价。NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO____FeO(选填“<”“>”“=”); 某种天然Nio晶体存在如图所示缺陷:一个Niz+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈屯中性。某氧化镍样品组成为 O.该晶体中Ni3+与Ni2+的离子数之比为____。
O.该晶体中Ni3+与Ni2+的离子数之比为____。
工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分
为钛酸亚铁( FeTiO3).其中一部分铁元素在风化过程中会转化为+3价。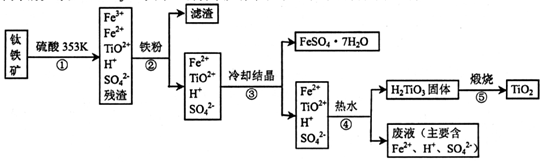
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为____。
(2)步骤③中,实现混合物的分离是利用物质的____(填字母序号)。
a.熔沸点差异 b溶解性差异 c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是____(填操作名称)。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为
(5)利用下图装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还原剂,可还原二氧化钛制各金属钛。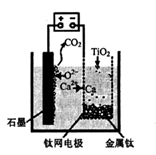
①阳极所发生的反应为________。
②在制备金属钛前后,CaO的总量不变,其原因是____。
(6)_T业上用4.0吨钛铁矿制得1. 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是____。
(假设生产过程中钛没有损失)
甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制
备的相关信息如下表:
(1)反应②是____反应(选填“吸热”“放热”)。
(2)据上表信息推导出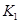 、
、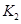 与
与 之间的关系,
之间的关系, =______用
=______用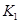 、
、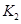 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻,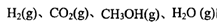 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速.v(H2)=若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。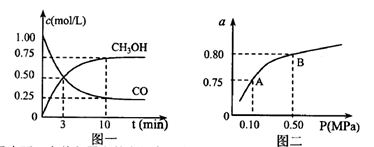
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是____。(用相应字母表示)
| A.容器中总压强不变 |
| B.混台气体的平均摩尔质量也始终保持不变, |
| C.混合气体的密度不变 |
| D.CO2(g)或CO(g)的浓度不变 |
(5)一定条件下甲醇与一氧化碳反应可合成醋酸。室温下,将a mol/L醋酸溶液与bmol/LNaOH溶液等体积混合。若溶液显中性,则a_________b(选填“>”“<”“=”)。若c(Na+)<c(CH3COO-),则溶液显____性(选填“酸”“碱…中”)。