(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而消除污染。该反应中涉及的微粒有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将这些微粒中除NO3-以外的微粒填入以下空格内(不用配平)。 
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应是4Al +3O2+6H2O ="4" Al(OH)3。电池正极的电极反应式是 ;消耗13.5 g Al时转移_________mole-。
(3)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点的金属。
已知:4Al(s) +3O2(g) = 2Al2O3(s)△H = -2830 kJ/mol △H = +230 kJ/mol
△H = +230 kJ/mol
C(s)+O2(g) = CO2(g) △H = -390 kJ/mol
铝与氧化铁发生铝热反应的热化学方程式是 ,铝热反应属于______(填字母)反应。
a.氧化还原 b.复分解 c.置换
酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下分析:
①通过样品的质谱分析测得A的相对分子质量为60;
②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:乙醇(CH3CH2OH)有三种氢原子(图1).经测定,有机物A的核磁共振氢谱示意图如图2: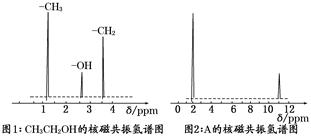
③对A的水溶液进行测定发现该溶液pH<7.
根据以上分析,写出A的结构简式________.
分子式为C2H4O2的结构可能有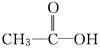 和
和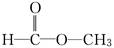 两种,为对其结构进行物理方法鉴定,可用__________________或______________________.
两种,为对其结构进行物理方法鉴定,可用__________________或______________________.
(1)若为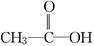 ,则红外光谱中应该有________个振动吸收;核磁共振氢谱中应该有________个峰.
,则红外光谱中应该有________个振动吸收;核磁共振氢谱中应该有________个峰.
(2)若为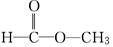 ,则红外光谱中有________个振动吸收;核磁共振氢谱中应有________个峰.
,则红外光谱中有________个振动吸收;核磁共振氢谱中应有________个峰.
(1)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O
反应中氧化剂是,氧化产物是;当有lmol电子发生转移时,生成氯气的体积(标准状况)。
(2)在一定条件下,RO3n-和氯气可发生如下反应:
RO3n-+C12+2OH-="===" RO4-+2C1-+H2O
由以上反应可知在上过程中RO3n-被(填“氧化”或“还原”),RO3n-中元素R的化合价是。
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是;
(2)化学性质最不活泼的元素是,其原子的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的是,碱性最强的是 ,呈两性的氢氧化物是;(填写化学式)
(4)在③~⑦元素中,原子半径最大的是,原子半径最小的是 ;
(5)比较①和⑥的气态氢化物的稳定性: > (填写化学式)
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
最高正价和最低负价的绝对值之差为2 |
| B |
最外层电子数是内层电子数的3倍 |
| C |
1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D |
原子最外层电子数等于其周期序数 |
| E |
负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2) D在周期表中的位置为 ________________;
(3)B和C简单离子的半径大小为________>_______;(用离子符号表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_______(填序号);
a.比较两种单质的颜色
b.比较氢化物的稳定性
c.依据两元素在周期表中的位置
d.依据两元素单质在自然界中的存在状态
(5)C和E形成的化合物是,所含的化学键的类型为 。