某实验小组用如图所示装置进行铜与浓硫酸反应的实验探究。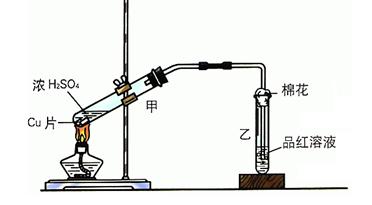
(1)写出甲中反应的化学方程式: 。
(2)乙试管口的棉花应沾有的试剂是 ,其作用是 。
(3)实验小组成员观察乙试管内液体变化是 。
(4)充分反应后,若甲试管中有铜片剩余,继续向甲中加入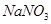 溶液,发现铜片溶解,此反应的离子方程式为 。
溶液,发现铜片溶解,此反应的离子方程式为 。
(5)在100mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。(填字母)
| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。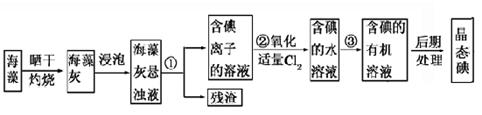
(1)指出提取碘的过程中有关的实验操作名称:①________________,③_______________。
写出实验②中有关反应的离子方程式:_________________________________。
(2)提取碘的过程中,可供选择的有关溶剂是________________________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,乙二醇 |
(3)为了使海藻灰中碘离子转化为碘的有机溶液,实验室准备了烧杯、玻璃棒、锥形瓶、酒精灯、导管、圆底烧瓶,石棉网以及必要的夹持仪器、物品。如上流程图所示,还缺少的玻璃仪器是_________________________。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出下图实验装置中的错误之处: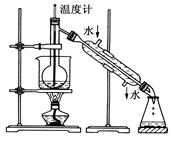
①______________________;
②__________________________;
③________________________。
(5)进行上述蒸馏法操作时,使用水浴的原因是_______________;最后,晶态碘在__________________里聚集。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。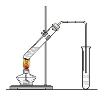
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是 。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球。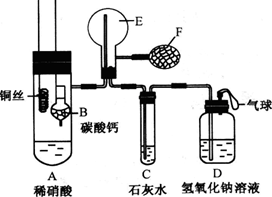
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先除去其中的空气。其中第一步实验操作为: 。从装置的设计看,确定E中空气已被赶尽的实验现象是 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。有人认为E中收集到的可能是H2而不是NO,如何证明? 。
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。你认为装置应改进的地方是 。
(4)装置D的作用是 。
海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下: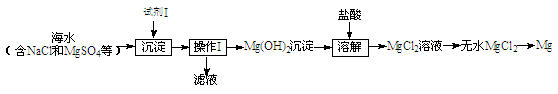
①试剂Ⅰ适宜选用 (填序号)。
A.盐酸 B.石灰乳 C.氯化钠溶液
②操作Ⅰ的名称是 。
③工业上通过电解熔融的MgCl2制备金属Mg,该反应的化学方程式是 。
(2)下图是某课外小组在实验室模拟从海水中提取溴的实验装置。
A装置中通入Cl2一段时间后,改通热空气,将Br2吹出至B装置。
①A装置中发生反应生成Br2的离子方程式为 。
②B装置中,Br2被SO2还原,B装置中产生的两种主要阴离子的符号为 、 。
③C装置中NaOH溶液的作用是 。
碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用。
(1)人体中碘的重要来源之一是加碘食盐。加碘食盐中的碘元素以碘酸钾(KIO3)的形式存在,其碘元素的化合价是__________。加碘食盐的食用方法是“待食品熟后加入”,说明碘酸钾在受热时易__________。
(2)海带或海苔中含有丰富的碘元素,也是人体碘的一种来源。取海带灰的浸取液加硫酸酸化,再加入少量H2O2溶液与淀粉溶液,溶液变蓝,证明海带中含有碘元素。反应的离子方程式是________。
(3)2012年3月,北京市最新规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
I. 用天平准确称取10.0 g食盐样品,加适量蒸馏水使其完全溶解。
II. 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
III. 以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液6.0 mL,恰好反应完全。(已知: )
)
①步骤II中反应的离子方程式是__________。
②步骤III中判断反应恰好完全的现象是__________。
③上述实验样品中碘含量是__________mg/kg,符合北京市规定。