(每空2分,共14分)某河道两旁有甲乙两厂。它们排放的工业废水中,
共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____________。乙厂的废水中含有另外三种离子。
对于该两厂的废水,可采取下列两种方法来处理。
(1)如果在废水中加一定量 (选填:活性炭或铁粉),可以发生反应,离子方程式是 ,并且能够回收其中的金属 (填写金属元素符号)。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式: ________________; ____________________。经过滤后的废水主要含 ,可用来浇灌农田。
下图所示是分离混合物时常用的仪器,回答下列问题:
(1)写出仪器C、E的名称、
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙:②花生油和水:
(3)下列关于仪器的使用说法正确的是
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于向酒精灯中添加酒精
C.C仪器在放出液体时应打开上边的瓶塞
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.制蒸馏水时E仪器中水的流向是上进下出
(4)若向C装置中加入碘水和足量CCl4,充分振荡后静置,会观察到什么现象?
(5)碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:
A.汽油 B.CCl4 C.酒精 D.醋酸
实验室用Na2CO3·10H2O晶体配制0.02 mol/L的Na2CO3溶液480 mL。
(1)① 实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 ;
② 实验中两次用到玻璃棒,其作用分别是 、 。
(2) 应用托盘天平称取Na2CO3·10H2O晶体的质量为: g。
(3)根据下列操作对所配溶液的浓度各有什么影响,将其序号填在下面空格:
①碳酸钠晶体失去了部分结晶水;②用“左码右物”的称量方法称量晶体;
③碳酸钠晶体不纯,其中混有氯化钠;④容量瓶中原有少量蒸馏水。
⑤定容时俯视液面;⑥摇匀后发现液面低于刻度线再加水。
其中引起所配溶液浓度:a.偏高的有 ;
b.偏低的有 ;
c.无影响的有 。
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)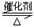 2SO3(g)ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
2SO3(g)ΔH=-92.3KJ/mol,反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为0.1MPa):
| 时间min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
| n(SO2) |
2.00 |
1.92 |
1.84 |
1.76 |
1.76 |
1.64 |
1.52 |
1.40 |
1.40 |
1.40 |
| n(O2) |
1.00 |
0.96 |
0.92 |
0.88 |
0.88 |
0.82 |
0.76 |
0.70 |
0.70 |
0.70 |
| n(SO3) |
0 |
0.08 |
0.16 |
0.24 |
0.24 |
0.36 |
0.48 |
0.60 |
0.60 |
0.60 |
回答下列问题:
(1)___________________________时段,反应处于平衡状态。
(2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是_____________;平衡向____________方向移动。(填“正”、“逆”或“不”)
(3)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。,Fe2O3和NiO作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe2O3的 主要优点是_____________。
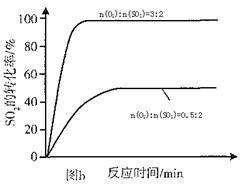
(4)科研小组在3800C Fe2O3作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b。请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线。
氯气在298K、100kPa时,在1L水中可溶解0.090mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________________;
(2)根据离子方程式,计算该反应的平衡常数(水视为纯液体,列式计算,保留2位有效数字)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;(填“正”、“逆”或“不”)
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。(填“正”、“逆”或“不”)
(5)新制氯水经光照一段时间后溶液c(H+)增大,请运用平衡移动原理进行解释:__________________。
常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ.mol-1)下表是一些键能数据(kJ·mol-1)
| 化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
| C-F |
427 |
C-Cl |
330 |
C-I |
218 |
| H-H |
436 |
S=S |
255 |
H-S |
339 |
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:_________ <C-Br键能<__________ (回答数值和单位)
(2)热化学方程式2H2(g)+S2(g) =2H2S(g);△H= QkJ·mol-1;则Q=
(3) 已知下列热化学方程式:
O2 (g) = O+2(g) + e— 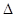 H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1
PtF6(g) + e—= PtF6—(g)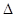 H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1
O2+PtF6—(s) = O2+(g) + PtF6—(g)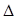 H3=" +482.2" kJ·mol-1
H3=" +482.2" kJ·mol-1
则反应O2(g) + (g) = O2+PtF6— (s)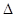 H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。