(12分) X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
①分别通入YX2和W2,在装置A中观察到的现象是否相同 (填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为 ;若装置D中装的是五氧化二钒,
当通入足量YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |
12.4g Na2R 含有Na+0.4mol,则Na2R的摩尔质量为,R的相对原子质量为,含R1.6g 的Na2R的物质的量为
现有34g某气体,它的摩尔质量为17g/mol,则:
(1)该气体的物质的量为mol
(2)该气体含有的分子数约为个
(3)该气体在标准状况下占有的体积约为L
(4)将该气体完全溶解于水配成2L溶液,其物质的量浓度为mol/L
河南的郑州、洛阳及南阳市率先使部分汽车采用封闭运行方式,试用新的汽车燃料——车用乙醇汽油。乙醇,俗名酒精,它是以玉米、小麦、薯类等为原料经发酵、蒸馏而制成的。乙醇进一步脱水,再加上适量汽油后形成变性燃料乙醇。而车用乙醇汽油就是把变性燃料乙醇和汽油按一定比例混配形成的车用燃料。结合有关知识,完成以下问题:
(1)乙醇的结构简式为_________________。汽油是由石油分馏所得的低沸点烷烃,其分子中的碳原子数一般在C5—C11范围内,如戊烷,其分子式为_________________,其同分异构体结构简式分别为_______________________、________________________、_______________________。
(2)乙醇可由含淀粉〔(C6H10O5)n〕的农产品(如玉米、小麦、薯类等)经发酵、蒸馏而得,这就是酿酒。酿酒主要有两步:①淀粉+水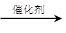 葡萄糖(C6H12O6) ②葡萄糖
葡萄糖(C6H12O6) ②葡萄糖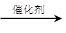 乙醇。
乙醇。
请写出淀粉生成葡萄糖的化学方程式:___________________________________。
(3)乙醇充分燃烧的产物为_____________和_____________。
(4)车用乙醇汽油称为环保燃料,其原因是________________________________。
已知NO2转化为N2O4的反应是放热反应且是可逆反应:2NO2 (g) N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。
N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。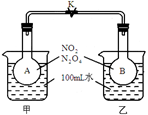

图1图2
(1)图1中___________瓶中气体颜色更深?(填“A”或“B”)。请比较平衡时反应速率:A瓶__________B瓶;(填“>”“<”或“=”)
(2)在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如上图2所示。请比较图2中A、B两点混合气体的平均相对分子质量:A点_________B点。(填“>”“<”或“="”" )
(3)平衡常数定义为一定条件下,可逆反应平衡时产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积比。即aA(g)+bB(g) pC(g)+qD(g)中K=
pC(g)+qD(g)中K= 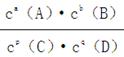
下如:N2(g)+3H2(g) 2NH3(g)的平衡常数表示式K=
2NH3(g)的平衡常数表示式K=
①2NO2 (g) N2O4(g)的平衡常数表达式K=
N2O4(g)的平衡常数表达式K=
②平衡常数K的具体值会随温度而改变。请比较上图2中A点和B点所对应的平衡常数数值。A点____________B点(填“>”“<”或“=”)。
下图是几种有机物的转换关系,请按要求填空: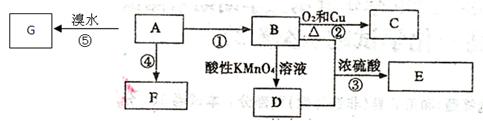
已知:A是来自石油的重要有机化工原料,对水果有催熟作用;75%的B可用于医用消毒;E是具有果香味的有机物;F是一种高聚物,可制成多种包装材料。
(1)A的分子式为,A和酸性高锰酸钾溶液作用的现象是:。
(2)C的名称,F的结构简式为。
(3)D分子中的官能团名称是,请设计一种实验来验证D物质存在该官能团的方法是
。
(4)请写出反应⑤的方程式:。
(5)请填写反应类型:A生成F;
(6)下列关于A和F的叙述正确的是。
| A.A常温下是气体,为纯净物;F常温下是固体,为混合物 |
| B.A与F的化学性质完全相同 |
| C.取等质量的A和F完全燃烧后,生成的CO2和H2O的质量分别相等 |
| D.取等物质的量的A和F完全燃烧后,生成的CO2和H2O的物质的量分别相等 |