(10分)(1)下列实验方法合理的是________。
| A.用加热法除去食盐固体中的氯化铵 |
| B.将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取 |
| C.实验室制取Al(OH)3:往AlCl3溶液中加入NaOH溶液至过量 |
| D.往FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质 |
(2)SiO2广泛存在于自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式
________________________________________________________________________。
(3)铝是一种重要金属:铝与NaOH溶液反应的离子方程式为:
________________________________________________________________________。
(4)将10.7 g氯化铵固体与足量消石灰混合加热使之充分反应。生成气体在标准状况下的体积是________L。
(10分)近年来,国际原油价格大幅上涨,促使各国政府加大生物能源生产,其中酒精汽油已进入实用化阶段。
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):
。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是________。在浓硫酸存在下加热,乙醇与Y反应可生成一种有香味的物质W,化学方程式为。
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷(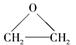 ),该反应的原子利用率为100%,反应的化学方程式为。
),该反应的原子利用率为100%,反应的化学方程式为。
物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,
请按要求回答下列问题。
⑴组成金属A的元素在周期表的位置是_____________,
D的化学式是__________________
⑵写出反应“C→F”的离子方程式;
⑶写出反应“ I→J”的离子方程式;
⑷写出金属 H与水蒸气在高温下反应的化学方程式。
(一)随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
(1)维生素C具有还原性,将其溶液滴入碘水中,反应后单质碘转化为(填化学式),为证明该反应的发生,常用试剂检验。
(2)淀粉、油脂、蛋白质属于天然有机高分子的为
(3)糖类、油脂、蛋白质都是人体必需的营养物质。油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和___________(写名称)。氨基酸是组成蛋白质的基本结构单元,中一定含有的官能团是氨基(—NH2)和____________(写名称)。人体中共有二十多种氨基酸,其中人体自身__________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。在淀粉酶的作用下最终水解为(写化学式),部分该产物在体内被氧化放出能量,供人体活动需要。
(二)材料是人类赖以生存和发展的重要物质基础。
⑴生产硅酸盐水泥和普通玻璃都需要用到的主要原料是(填名称);
⑵石英玻璃化学稳定性强、膨胀系数小,是一种特种玻璃,石英玻璃的主要成分是
(填化学式);有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是
一种。(选填“橡胶”或“纤维”或“塑料”)
⑶聚乙烯、聚氯乙烯都是线型高分子树脂,它们制成的塑料具有(选填“热塑性”或“热固性”)
⑷玻璃钢具有耐腐蚀、质量轻、强度高的性能,它属于材料(选填“合金”或“复合”)
(三)2010年第41届世博会将在上海举办,世博会的主题是“城市,让生活更美好”。
低碳经济是以低能耗、低污染、低排放为基础的经济模式,上海世博会的亮点之一是实现“二氧化碳零排放”。
①现在人们使用乙醇汽油作为汽车燃料充分体现了低碳经济,物质的量相同的乙醇与汽油(设为C8H18)均完全燃烧产生的CO2的物质的量之比为;人们已尝试使用
作为汽车燃料可真正实现“二氧化碳零排放”。
②世博停车场,安装有汽车尾气催化光解设施,它能将汽车尾气中CO和NOx反应生成可参与大气生态环境循环的无毒气体,写出CO和NOx在一定条件下反应的化学方程式:
。
③世博会期间将用可降解的“玉米塑料”替代一次性饭盒、并可被用来制作世博会证件及胸卡,目的是为了防止产生 污染。
化合物A(C8H8O3)为无色液体,难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A苯环上取代时可生成两种一取代物,化合物D能使FeCl3溶液显紫色,G能进行银镜反应。E和H常温下为气体。试回答:
(1)写出下列化合物的结构简式:
A:;B:;G:
(2)反应类型:(I);(Ⅱ)。
(3)写出D→H的化学方程式:。
(4) L是D的同分异构体,L具备下列条件。
①L能与使FeCl3溶液显紫色
②能进行银镜反应
③其中一种水解产物的核磁共振氢谱表明有四组峰
写出L与氢氧化钠溶液的化学方程式:。
有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对
分子质量是90,则A的分子式是______________________。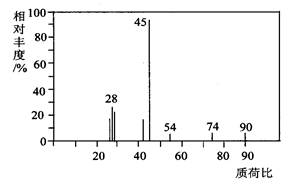
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是______________。
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是_________________________________。
(4)0.1 mol A与足量Na反应,在标准状况下产生H2的体积是__________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是___________________________。