物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,其中气体D、E为单质,
请按要求回答下列问题。
⑴组成金属A的元素在周期表的位置是_____________,
D的化学式是__________________
⑵写出反应“C→F”的离子方程式 ;
⑶写出反应“ I→J”的离子方程式 ;
⑷写出金属 H与水蒸气在高温下反应的化学方程式 。
(5分)含有相同原子个数的SO2和SO3,其质量比为,摩尔质量比为,物质的量比为,其中所含氧原子个数比为,硫原子个数比为.
下图中的每一个方格表示有关的一种反应物或生成物,其中A,C,D为无色气体.请填下列空白: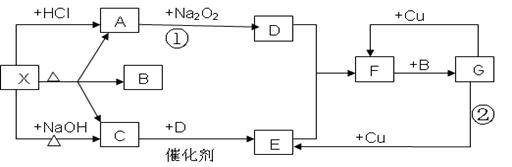
(1)物质X可以是______________________,C 是____________,F是____________.
(2)反应①化学方程式是________________________________________________。
(3)反应②的离子方程式是______________________________________________。
有A、B、C、D、E五种烃,具有下列性质:①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO2均为4.48L(标准状况),A和D燃烧所得的CO2都是前三者的3倍;②在适宜条件下,A、B、C都能跟氢气发生加成反 应,其中A可以转化为D、B可以转化为C,C可以转化为E;③B和C都能使溴水或酸性KmnO4溶液褪色,而A、D、E无此性质;④用铁屑作催化剂时,A可与溴发生取代反应。判断A、B、C、D、E各是什么物质,写出结构简式.
应,其中A可以转化为D、B可以转化为C,C可以转化为E;③B和C都能使溴水或酸性KmnO4溶液褪色,而A、D、E无此性质;④用铁屑作催化剂时,A可与溴发生取代反应。判断A、B、C、D、E各是什么物质,写出结构简式.
A_________B____ ______C__________D___________E_______。
______C__________D___________E_______。
现有CH4、C2H4、C2H2、C6H6四种烃,①当它们的物质的量完全相等时,完全燃烧耗O2最多的是,生成CO2最少的是,生成H2O最少的是;②当它们的质量相等时,完全燃烧耗O2最少的是,生成CO2最少的是,生成H2O最多的是。
以下有五种有机物
这些物质中______是苯的同系物, _________是苯及同系物发生取代反应后的生成物, ________是苯发生加成反应后的生成物。(用上述有机物序号填空)。