以下是某研究小组探究影响反应速率部分因素的相关实验数据。
| 实验序号 |
H2O2溶液溶质质量分数% |
H2O2溶液体积/mL |
温度℃ |
MnO2的用量/g |
收集氧气的体积/mL |
反应所需 的时间/s[ |
| ① |
5 |
1 |
20 |
0.1 |
4 |
16.75 |
| ② |
15 |
1 |
20 |
0.1 |
4 |
4.04 |
| ③ |
30 |
5 |
20 |
0.1 |
2 |
49.21 |
| ④ |
30 |
5 |
20 |
0.5 |
2 |
10.76 |
(1)通过实验①和②对比可知,化学反应速率与 有关;
从实验 和 对比可知,化学反应速率与催化剂的关系是:
。
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:
。
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量 (选填“减小”或“不变”或“增大”)。
(4)还有哪些因素可能影响该反应的速度呢?
请说出你的一个猜想: 。
【2015年福建省福州市】(10分)分析处理图表中的信息是学习化学的一种重要方法。
(1)下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答: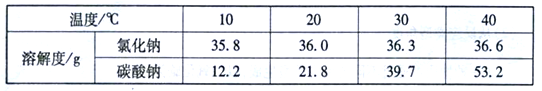
① 40℃时,氯化钠的溶解度为____________g。
②碳酸钠的溶解度随温度的升高而____________(填“增大”或“减小”)。在20℃时,
将100g的水加入30 g碳酸钠中,充分搅拌后得到的是____________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30度,该溶液的溶质质量分数为____________ (计算结果精确到0.1%)。
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是______。
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式______________________。图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是____________(填标号)。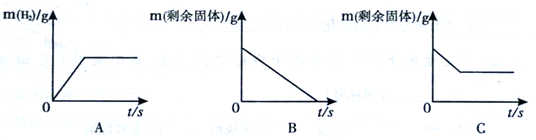
【2015年山东省济南市】我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发前景十分远大。
(1)我国海盐年产量3千多万吨,居世界第一位,目前从海水中提取食盐的方法主要为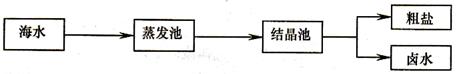
在蒸发池中促进水分蒸发,主要是利用了下列各项中的____(填选项序号)。
①潮汐能 ②生物能 ③电能 ④太阳能 ⑤化学能
(2)金属镁广泛应用于生活、生产和国防工业。从卤水中提取镁的过程如图所示:
在上述转化过程中,①处所发生的反应属于__________反应(填“中和”“复分解”“氧化”“化合”“分解”之一)。
(3)海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素。KCl和KNO3的溶解度曲线如右图所示。试回答下列问题: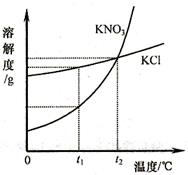
①t1℃时,KCl饱和溶液的溶质质量分数,一一一KNO3饱和溶液的溶质质
量分数(填“大于”“小于”“等于”之一)。
②已知20℃时,KNO3的溶解度为31.6g;80℃时,KNO3的溶解度为169g。在20℃时,向盛有200g水的烧杯中加入80g硝酸钾,充分溶解,得到该温度下硝酸钾的 (填“饱和”与“不饱和”之一)溶液,若使烧杯内的物质逐渐升温至80℃,在该温度下,最后所得溶液中溶质与溶剂的质量之比为______________(填最筒整数比)。
【2015年上海市】溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
①下表是KNO3、KNO3在不同温度下的溶解度(单位:g/100g水)。
| 温度(℃) |
0 |
20 |
40 |
60 |
80 |
100 |
| KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
| KNO3 |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
I.上表中的两种物质在40℃时, 的溶解度较大;请用相应的数据列式表示该温度是KNO3饱和溶液的质量分数 (不要求计算)。
II.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法 。
III.20℃时,将20gNaCl放入50g水中,所得溶液的质量是 g。
IV.从NaCl溶液中得到NaCl晶体的方法是 。
②用硫酸铜进行如下图所示的实验,完成下列填空(用编号表示)。
所得三个溶液中:一定属于饱和溶液的是 ,溶液中溶剂质量的大小关系是 。
【2015年福建省厦门市】10分)黄铜矿(主要万分CuFeS2)经初步处理后,所得溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4。某同学通过废铁屑与溶液甲反应,制取补血剂原料碳酸亚铁并回收铜。主要步骤如图7所示:
(1)Fe2(SO4)3与铁反应的化学方程式:x Fe2(SO4)3+ y Fe= z FeSO4,其中x、y、z为化学计量数,z的值为_____________。
(2)步骤Ⅰ中,生成铜的化学方程式:__________________________。
(3)步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是__________________
__________________________________。
(4)步骤Ⅱ中加入一种可溶性可实现其转化,从复分解反应发生的条件分析,该试剂可以是________。
(5)步骤Ⅲ回收铜的方法为_______________________________________。
【2015年湖北省黄冈市】王老师在某工厂废水处理池中提取一瓶含有AgNO3、Cu(NO3)2和Al(NO3)3的工业废水样品带回实验室。静置,取上层清液,加入锌粉,充分反应后过滤,得到滤液甲和滤渣乙。请你和你的化学小组完成以下探究(不考虑杂质干扰)。
【提出问题】滤渣乙是什么?
【做出猜想】小明认为滤渣乙是银,小东认为滤渣乙是银和铜,小华认为滤渣乙是银、铜和铝,你认为滤渣乙还可能是______________。
【交流讨论】大家经过讨论后,认为小华的猜想错误,理由是_______________________。
【实验探究】设计实验探究滤渣乙的成分,请填写下列空白:
| 实验步骤 |
现象 |
结论 |
| 实验1:取滤渣乙加入盐酸 |
无气体产生 |
滤渣乙可能是___________ |
| 实验2:取滤液甲加入_____ |
无蓝色沉淀 |
滤渣乙一定是___________ |
【反思交流】通过交流,大家认为在滤液甲中加入稀盐酸,当观察到______________,也能得出实验1的结论。