【2015年山东省济南市】我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发前景十分远大。
(1)我国海盐年产量3千多万吨,居世界第一位,目前从海水中提取食盐的方法主要为
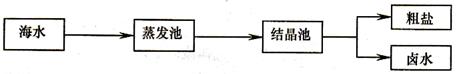
在蒸发池中促进水分蒸发,主要是利用了下列各项中的____(填选项序号)。
①潮汐能 ②生物能 ③电能 ④太阳能 ⑤化学能
(2)金属镁广泛应用于生活、生产和国防工业。从卤水中提取镁的过程如图所示:

在上述转化过程中,①处所发生的反应属于__________反应(填“中和”“复分解”“氧化”“化合”“分解”之一)。
(3)海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素。KCl和KNO3的溶解度曲线如右图所示。试回答下列问题:
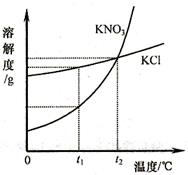
①t1℃时,KCl饱和溶液的溶质质量分数,一一一KNO3饱和溶液的溶质质
量分数(填“大于”“小于”“等于”之一)。
②已知20℃时,KNO3的溶解度为31.6g;80℃时,KNO3的溶解度为169g。在20℃时,向盛有200g水的烧杯中加入80g硝酸钾,充分溶解,得到该温度下硝酸钾的 (填“饱和”与“不饱和”之一)溶液,若使烧杯内的物质逐渐升温至80℃,在该温度下,最后所得溶液中溶质与溶剂的质量之比为______________(填最筒整数比)。
以下是我们日常生活中常用各种清洗剂,选择适当的用品可以得到更好的清洗效果。
| 名称 |
洗涤灵 |
洁厕灵 |
炉具清洁剂 |
污渍爆炸盐 |
漂白粉 |
| 产品样式 |
 |
 |
 |
 |
 |
| 有效成分 或功能 |
清洗油污 |
盐酸 |
氢氧化钠 |
过碳酸钠 |
消毒 |
(1)我们使用洗涤灵清洗餐具上的油污,这是因为它具有的功能。
(2)以下物质可以使用洁厕灵清洗的是填字母序号)。
a.铁锈 b.油渍 c.水垢(主要成分为碳酸钙和氢氧化镁)
(3)取上述一定量的炉具清洁剂,滴加几滴酚酞溶液,溶液变色,若将洁厕灵与炉具清洁剂混合,可以发生下图所示的化学反应。图中a微粒的化学式为。
(4)“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,发生的化学反应方程式为。
(5)化学小组发现一袋包装破损的漂白粉,同学们对漂白粉其漂白作用是否失效产生了疑问。(当有效成分完全消失时,则漂白粉就完全失效;部分消失时,则为部分失效)。
I.查阅资料:
①漂白粉的主要成分是Ca(ClO)2、CaCl2和Ca(OH)2,其有效成分是Ca(ClO)2。
②Ca(ClO)2可溶于水,漂白原理是:它在空气中发生反应:
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO。
③ HClO不稳定,易分解生成HCl和一种常见的单质气体。
④ CaCl2的水溶液呈中性,HClO的水溶液呈酸性。
⑤ HClO可使有色物质(如:品红溶液)褪色。
II.交流讨论:
该小组同学经过分析得出:HClO分解时除生成HCl外,生成的另一种常见气体是。
III.实验探究:下表是探究某漂白粉是否完全失效的实验,请根据表中结论,进行填空。
| 实验步骤 |
实验现象 |
实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体,。 |
。 |
漂白粉的漂白作用已完全失效。 |
IV.继续探究:同学们对某完全失效后的漂白粉的成分很感兴趣,并作进一步探究。在老师的帮助下,同学们对该失效后的漂白粉成分进行猜想:
猜想一:CaCl2和CaCO3;猜想二:;
小明同学认为猜想中的成分CaCO3,除漂白粉的有效成分在空气中发生反应生成外,还有其它来源,请你用化学方程式表示。
小聪同学进行实验证明失效后的漂白粉的成分符合猜想一,而与猜想二不符。小聪同学的实验方案是:。
化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理。请你参与并回答相关问题。
实验一:表面除锈
甲组:将锈铁器放入适量稀硫酸中,微热。观察到①溶液变成黄色,铁锈逐渐消失;②一段时间后,锈层完全消失,铁器表面有细小气泡产生;③黄色溶液逐渐变为浅绿色。
现象①发生的化学反应方程式为:____________________________________,②中铁器表面的气泡是________;大家对现象③不理解,老师补充说明了,金属铁具有还原性,能将正三价的铁离子还原成亚铁离子。
乙组:在锈铜钱中加入适量稀硫酸。观察到①绿色锈层很快消失,同时产生大量气泡,溶液变成蓝色;②将气体收集,通入澄清石灰水,石灰水变浑浊。由此,小军等同学推断,绿色锈层中肯定含有的元素有_________________。
实验二:废液回收
废液桶中收集了溶有大量FeSO4、CuSO4的废水,若直接排放到下水道,不仅造成重金属污染而且浪费资源。小组讨论后设计了如下除去铜离子,回收硫酸亚铁晶体和铜的实验方案:
请完成下列有关问题:
(1)废水在加入金属X前需进行过滤,目的是将其中性杂质除去。
(2)金属X是,其加入废水后发生反应的化学方程式为;
溶液Y是,利用其除去铜中杂质,有关反应的化学方程式为。
(3)从滤液中获取硫酸亚铁晶体的操作方法是。
在做氧化铜、木炭反应的实验时,往往会发现充分反应后试管中仍有黑色固体。晓明对此进行了探究,并邀请你一起参与。
【提出问题】氧化铜与木炭充分反应结束后,试管中的黑色固体是什么?
【猜想假设】黑色固体可能是①木炭
②
③
【查阅资料】①铜、木炭不与稀硫酸反应。
②氧化铜能与稀硫酸反应形成蓝色溶液。
【实验验证】晓明设计的实验方案是:取少量该黑色固体在空气中灼烧,观察现象。如果猜想①正确,现象应该是。
【实验设计】科学探究的方法有多种,请你再设计一种方法来证明晓明的猜想②或③正确。(请简明写出操作、步骤和结论)
。
【反思整理】若试管壁上沾有了黑色固体氧化铜,除去黑色氧化铜的方法是(用化学方程式表示);试管洗净的标准是。
小强在做“盐酸中和氢氧化钙溶液”的实验时,滴加盐酸前忘了加入指示剂。于是他对所得溶液中的溶质进行了猜想。
【提出猜想】猜想一:只有氯化钙
猜想二:除氯化钙外,还有HCl
猜想三:除氯化钙外,还有_______________。
【实验验证】
| 实验操作 |
实验现象 |
结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 |
无色酚酞试液不变色 |
猜想__________不成立 |
【分析与思考】
(1)得出上述结论的理由是_____________________________________
(2)为了进一步确定溶质的成分,小强认为可以进行以下实验:
取样,加入适量的碳酸钠溶液,若,则猜想二成立;若,则猜想一成立,该反应的化学方程式为。
(1)小方用右图所示装置对二氧化碳的灭火实验进行研究,观察到的现象是______,实验的结论是_______。
(2)【提出问题】二氧化碳能否支持燃烧?
【猜想假设】镁能在二氧化碳中燃烧。
【查阅资料】①氧化镁、氢氧化镁均是白色难溶于水的固体。
②MgO+2HCl= MgCl2+H2O 、
③MgCl2+2NaOH=Mg(OH)2↓+2NaCl 。
【实验探究】
①右图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。
②为检验生成物的成分,做如下实验。
| 实验步骤 |
实验现象 |
实验结论和化学方程式 |
|
| 向广口瓶中加入过量盐酸,充分反应后过滤,在滤纸上留有黑色固体。 |
I、将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯。 |
黑色固体燃烧,烧杯内壁出现白色浑浊。 |
黑色固体是______;反应的化学方程式是______。 |
| II、取少量滤液于试管中,逐滴加入氢氧化钠溶液。 |
开始_______,后有白色沉淀产生。 |
白烟的成分是______。 |
③为了回收II中的白色沉淀,证明沉淀完全的实验方法是______(要求写出步骤、试剂、现象和结论)。
【反思提高】实验室中由某些活泼金属引起的着火,不能用二氧化碳灭火,应用细沙灭火。