用实验确定某酸HA是弱电解质,两同学的方案是:
甲:①称取一定质量的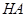 配制
配制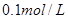 的溶液
的溶液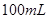 ;
;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各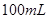 ;
;
②分别取这两种溶液各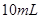 ,加水稀释为
,加水稀释为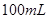 ;
;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH_______1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是_________(多选扣分)
(a)装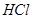 溶液的试管中放出
溶液的试管中放出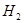 的速率快;
的速率快;
(b)装HA溶液的试管中放出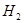 的速率快;
的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你再提出一个合理且比较容易进行的方案(药品可任取),作简明扼要表述____________________________________。
有5 种 短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合
短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合 物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列
物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列 问题:
问题:
(1)写出五种元素的名称:ABCDE。
(2)用电子式表示离子化合物A2B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质;B与E形成的化合物;
A、B、E 形成的化合物;D、E形成的化合物
形成的化合物;D、E形成的化合物
不同的物质不仅组成不同、结构不同 ,所包含的也不同。放热反应的宏观表现是,其微观表现是。
,所包含的也不同。放热反应的宏观表现是,其微观表现是。
一切化学反应除了有质量的 变化外,还伴随着的变化,它们分别遵循定律和定律。能量变化通常主要表现为的变化,即或者。
变化外,还伴随着的变化,它们分别遵循定律和定律。能量变化通常主要表现为的变化,即或者。
在NaCl、NaOH、N2、H2S中,只含有离子键的是,只含有 极性键的是,只含有非极性键的是,既含有离子键又含有极性键的是。
极性键的是,只含有非极性键的是,既含有离子键又含有极性键的是。
下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑾ |
⑿ |
(1)写出下列元素的元素符号:①②
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是,最不活泼的元素是。
,最活泼的非金属元素是,最不活泼的元素是。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是,碱性最强的是,呈两性的氢氧化物是。
(4)在③与④的单质中,化学性质较活泼的是,判断依据是;在⑧与⑿的单质中,化学性质较为活泼的是 ,判断依据是。
,判断依据是。
(5)⑾与⑿原子序数之差