鸡蛋壳中含有大量钙、少量镁和钾等元素。实验室可用图示流程测定鸡蛋壳中钙、镁元素含量。依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY。回答下列问题。
(1)测定Ca2+、Mg2+总含量时,控制溶液pH=10。若pH过大,测定结果将 (填“偏大”、“偏小”或“无影响”);
(2)测定Ca2+含量的关键是控制溶液的pH,使溶液中Mg2+形成沉淀,若要使溶液中c(Mg2+)不大于1.2×10-7mol/L,则溶液pH应不小于 (已知:Ksp[Mg(OH)2]=1.2×10-11,上述实验均在室温下进行)。
(3)如果鸡蛋壳粉质量为mg,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是 。
(4)有同学提出可采用如下装置、通过测定鸡蛋壳与盐酸反应产生的二氧化碳的量就能测定鸡蛋壳中的钙的总含量。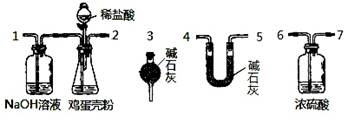
①采用该方法进行实验,各装置从左到右的连接顺序依次:
1—2—__ ________________(填各装置对应接口的数字序号)。
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?
答:________(填“准确”、“不一定准确”或“无法判断”)。
原因是___________________ __
。
某化学小组进行Na2SO3的性质实验探究。
(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
实验现象如下表:
| 编号 |
实验现象 |
| a |
溴水褪色 |
| b |
产生淡黄色沉淀 |
| c |
滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
① a中实验现象证明Na2SO3具有性。
② b中发生反应的离子方程式是。
③ 应用化学平衡原理解释c中现象(用化学用语及简单文字表述)。
(2)在用NaOH 溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
| n(SO32—): n(HSO3—) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
① 当吸收液中n(SO32-):n(HSO3-) ="10:1" 时,溶液中离子浓度关系正确的是(填字母)。
A.c(Na+) +c(H+) = 2c(SO32-) +c(HSO3-) + c(OH-)
B.c(Na+) > c(HSO3-) > c(SO32-) > c(OH-)>c(H+)
C.c(Na+) > c(SO32-) > c(HSO3-) > c(OH-)>c(H+)
②若n(SO32-):n(HSO3-) = 3:2,则0.8 mol NaOH溶液吸收了标准状况下的SO2 L。
锶(Sr)为第五周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物)制备高纯六水氯化锶的过程如下图:
请回答:
(1)加入少量30%H2O2的作用(用离子方程式表示);
(2)步骤③中氧化锶粉末的作用是,工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是;
(3)步骤④进行的实验操作为、,步骤⑥中,洗涤氯化锶晶体最好选用;
| A.水 | B.硫酸 | C.氢氧化钠溶液 | D.氯化锶饱和溶液 |
(4)指出下图中仪器b 的名称, 在抽滤时使滤纸紧贴布氏漏斗瓷板的操作是,抽气使滤纸紧贴在漏斗瓷板上;
(5)计算原工业碳酸锶粉末中碳酸锶的质量分数(列计算式即可)。
髙纯氧化铁(a-Fe2O3)是现代电子工业重要材料。实验室用硫铁矿烧渣 (Fe2O3、FeO、SiO2等)为原料制备髙纯氧化铁的步骤如下。请回答有关问题:
(1)过滤操作中的玻璃仪器为________。
(2)实验室需240mL4.8mol • L-1的硫酸溶液,若用18.4 mol • L-1的浓硫酸进行配制,所需要的最主要仪器为________。
(3)溶液X发生反应的离子方程式为________。
(4)简述如何检验溶液Z中的阴离子________。
(5)操作I的名称是________。列举W的一种用途________。
(6)某实验小组设计的氨气制备实验流程为:发生装置→净化→收集→尾气处理,则接口的连接顺序是_______________。
(7)将多余的氨气分别通入水中或盐酸中,若得到25℃0.1 mol.L-1的NH3 • H2O溶液或NH4Cl溶液,请你设计实验,比较NH3 • H2O的电离程度和NH4Cl的水解程度大小。
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。实验室用粗铜(含少量铁)制备CuSO4·5H2O的流程如下:
回答下列问题:
(1)实验室配制250 mL4.8 mol·L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要__________________________________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 |
Fe3+ |
Cu2+ |
Fe2+ |
| 开始沉淀的pH |
2.7 |
4.4 |
7.0 |
| 沉淀完全的pH |
3.7 |
6.4 |
9.6 |
除去Fe3+,溶液的pH应控在_______________范围,调pH可选用的试剂是____________。
(3)若制得的CuSO4·5H2O中存在杂质Cu(NO3)2,进一步提纯的实验操作名称是__________。
(4)获得的CuSO4·5H2O晶体表面附着杂质离子,常用酒精洗涤的原因是____________。
用标准的BaCl2溶液测定晶体的纯度时,发现纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_____________________________________________(任写一种)。
(5)实验室欲制取适量NO气体。下图中最适合的实验装置是__________(填序号),并注明装置中所需药品的名称。
A.__________,B.__________,C.__________,D.__________。(根据选择的装置可以填满也可以不填满)
某学习小组在实验室模拟侯氏制碱法制备纯碱,其实验流程如下:
请回答下列问题:
(1)食盐溶液中含SO42-等杂质,不能用于除去SO42-的试剂是_________(填序号)。
a. Ba(OH)2 b.Ba(NO3)2 c. BaCl2 d. Na2CO3
(2)实验制备碳酸氢钠用到下列装置:
①实验装置中各接口的连接是d接____,e接_____,c接f。实验过程中先通入氨气的原因_____________。
②析出晶体后的溶液中含有大量的NH4+,检验NH4+的方法是__________________。
③瓶g内的溶液是___________________________________________。
(3)由碳酸氢钠制备纯碱的过程中用到的主要仪器除酒精灯、泥三角、三脚架、玻璃棒外,还有__________。
(4)用图电解饱和NaC1溶液的方法来制取NaOH、C12和H2。
①反应中生成的C12从_______(填“A”或“B”)放出,检验C12所用试剂(用品)______________________。
②经过长时间电解后,向电解液中滴加酚酞试液,发现溶液并未变红色,试分析可能的原因__________。