标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂和还原剂
(1) Fe2O3+3Al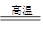 Al2O3+3Fe
Al2O3+3Fe
氧化剂是 ,还原剂是
(2)2KMnO4 + 16HCl(浓) ="==" 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
氧化剂是 ,还原剂是
已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
(1)B的结构简式是.
(2)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是.
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):. 化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:)
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:)
(3)甲的结构简式是.由甲苯生成甲的反应类型是.
(4)乙中有两种含氧官能团,反应③的化学方程式是:.
(5)普鲁卡因有两种水解产物丁和戊.
①戊与甲互为同分异构体,戊的结构简式是.
②戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域.该聚合反应的化学方程式是.
③D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键.则D与F在一定条件下反应生成丁的化学方程式是.
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)白磷单质的中P原子采用的轨道杂化方式是;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为;
(3)As原子序数为,其核外M层和N层电子的排布式为;
(4)NH3的沸点比PH3(填“高”或“低”),原因是.PO43-离子的立体构型为;
(5)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13.硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因;
②硝酸比亚硝酸酸性强的原因;
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为cm(用含有a的代数式表示).在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为g (氧离子的半径为1.40×10-10m) 
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的极(填“正”或“负”),负极反应式为.用这种方法处理SO2废气的优点是.
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是.
②下列有关说法正确的是.
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是.
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式.
物质的转化关系如下图所示(有的反应可能在水溶液中进行).其中甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成.请回答下列问题:
请回答些列问题:
(1)写出甲的电子式是.
(2)写出反应Ⅰ的化学方程式.
(3)A溶于水得到得到溶液X,在25℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为用含a和b的代数式表示出该混合溶液中X的电离平衡常数.
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过如图装置处理污水.
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ.;Ⅱ..
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是.
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.
(已知:2SO2 (g)+O2(g) 2SO3(g)△H=-196.6 KJ·mol-1)
2SO3(g)△H=-196.6 KJ·mol-1)
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:.
(2)ΔH2 =
(3)恒温恒容时,1molSO2和2molO 2充分反应,放出热量的数值比∣ΔH2 ∣(填“大”、“小”或 “相等”)
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为,若溶液中发生了氧化还原反应,则该过程的离子方程式为.
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有.
a.升高温度;
b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g)
d.使用催化剂
(6)某SO2 (g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率 与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中SO3的含量最高的一段时间是.
与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中SO3的含量最高的一段时间是.