(10分)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3-也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成CuCl2-。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为 。
(2)元素N、P、S的第一电离能(I1)由大到小的顺序为 。
(3)HN3属于 晶体,与N3-互为等电子体的分子的化学式 (写1种)NH2-的电子式为 ,其中心原子的杂化类型是 。
(4)CuCl2-中的键型为 ,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为 。
(5)治癌药物B的结构简式为 。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。(已知25℃Ksp[Fe(OH)3]=4.0×10﹣38 lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是____________ 。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为_________________(填写数值)。
(2)将FeCl3溶液与NaHCO3 溶液混合,其离子方程式为 _______________。
(3)25℃时pH=3的溶液中,c(Fe3+)= mol•L﹣1要使Fe3+ 沉淀完全,pH应大于________。
(4)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3=CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为__________。
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是电化学过程的示意图。
已知甲池的总反应式为:2CH3OH+3O2+4KOH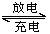 K2CO3+6H2O,请填空:
K2CO3+6H2O,请填空:
(1)充电时:①原电池的负极与电源______极相连,②阳极的电极反应为________。
(2)在此过程中若完全反应,乙池中B极的质量增加648g,则甲池中理论上消耗O2_______L(标准状况下)。
(3)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 / Mn(OH)3 |
| 开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
| 完全沉淀pH(c≤1.0×10-5mol/L) |
3.7 |
9.6 |
8.0 |
8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是____________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式_________________________。
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式______________________。
(4)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式为______________________。
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式 。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH 7(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为 。
②产品室中生成亚磷酸的离子方程式为 。
已知醋酸和盐酸是日常生活中极为常见的酸。
(1)常温常压,在 pH=5的稀醋酸溶液中,c(CH3COO‾)=_____________;下列方法中,可以使0.10 mol/LCH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol/L的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol/L
e.加入少量氯化钠固体
f.加入少量0.10 mol/L的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)__________V(醋酸),反应的最初速率为:
υ(盐酸)_________υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va________Vb;溶液中各离子的浓度按照由大到小排序为_________。
(4)已知:90℃时,水的离子积常数为Kw=38×10‾14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)。