FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。(已知25℃Ksp[Fe(OH)3]=4.0×10﹣38 lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是____________ 。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为_________________(填写数值)。
(2)将FeCl3溶液与NaHCO3 溶液混合,其离子方程式为 _______________。
(3)25℃时pH=3的溶液中,c(Fe3+)= mol•L﹣1要使Fe3+ 沉淀完全,pH应大于________。
(4)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3=CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为__________。
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是____________________________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
烧结法制氧化铝生产过程如下: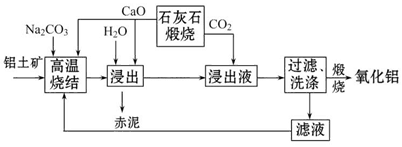
已知:
①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。
②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解的化学方程式____________。
(2)浸出时再加入CaO的目的是______________________________________。
(3)浸出液中发生的生成Al(OH)3的离子方程式为____________________________________。
(4)滤液的主要成分是_________(写化学式);滤液循环使用的优点有________ (任答一点)。
有100 mL NaOH溶液,先向其中逐渐通入一定量的CO2,随后向此溶液中逐滴加入4 mol/L的盐酸溶液,产生的CO2气体体积(标准状况下)与所加入盐酸溶液的体积之间的关系如图所示,试求: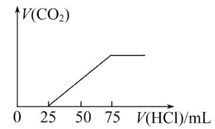
(1)NaOH在吸收CO2气体后,所得溶液中存在的溶质是:________,其物质的量是________。
(2)在加入盐酸情况下产生的CO2气体体积为(标准状况)________。
(3)原NaOH溶液的物质的量浓度是______________________________________;
若以Na2O2固体溶于水配得100 mL该溶液需Na2O2__________________________g。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______。
(2)上述反应中的氧化剂是______,反应产生的气体可用______吸收。
(3)As2S3和HNO3有如下反应: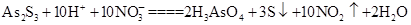 ,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
,若生成2 mol H3AsO4,则反应中转移电子的物质的量为______。若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2 L O2(标准状况)混合后用水吸收全部转化成浓硝酸,然后与过量的C反应,所产生的CO2的量______(选填编号)。
a.小于0.5 mol
b.等于0.5 mol
c.大于0.5 mol
d.无法确定
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。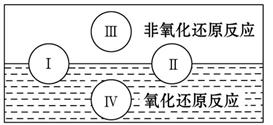
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________________,
其中水为_______剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
_____CuO+_____NH4Cl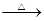 _____Cu+_____CuCl2+N2↑+_____H2O。
_____Cu+_____CuCl2+N2↑+_____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是_______(填元素名称),氧化剂是_______(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。每生成1 mol P4时,就有_______mol电子发生转移。