(10分)现有常温下的0.1 mol/L纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示):_____________________。
为证明你的上述观点,请设计一个简单的实验,简述实验过程:
____________________________________________________________________。
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的10%。请你设计实验证明该同学的观点是否正确_____________________________。
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是 ________。
| A.c(Na+)=2c(CO32-) |
| B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3) |
| C.c(CO32-)+c(HCO3-)=0.1 mol/L |
| D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
(4)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式:________________________。
某一反应体系中有反应物和生成物共6种:HC1、H2SO4、SnC12、SnC14、FeSO4、Fe2(SO4)3,反应前在溶液中滴加KSCN溶液显红色,反应后红色消失。
(1)该反应的氧化剂是。
(2)在该反应中,发生氧化反应的过程是→。
(3)写出并配平该反应的化学方程式,并标出电子转移的方向和数目:。
(4)SnC14与SnC12可用Hg2+来鉴别,HgC12与SnC12反应的产物是SnC14和Hg2C12(白色沉淀),该反应中还原剂与氧化剂的物质的量之比为。
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 |
T |
X |
Y |
Z |
| 性质 结构 信息 |
人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式;写出Z元素原子的原子结构示意图:;元素Y的最高价氧化物对应水化物的电子式______
(2)Z单质与Y最高价氧化物的水化物的水溶液反应的离子方程式
(3) 元素T与氟元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深 b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
有机物A可以通过不同的反应制得下列物质:
(1) 写出A → C的化学方程式:,
该反应类型为。
(2) 条件X是,推断B物质的结构简式为。
(3) 若E的结构中有两个六元环,则E的结构简式。
(4) R物质属于A 的同分异构体,其苯环上的一氯代物只有2种,性质如下:
试写出符合条件的R的结构简式。
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。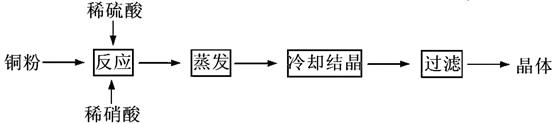
根据题意完成下列填空:
(1)理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为,发生反应的离子方程式为。
(2)实际制得的胆矾晶体中还是含有一些杂质,通常采用法提纯。
(3)实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是 。请在右图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
。请在右图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
(4)上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是。
| A.醋酸 | B.草酸 | C.苯甲酸 | D.苯酚 |
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)可以判断该分解反应已经达到化学平衡的是___________。
A.
B.密闭容器中总压强不变
C.密闭容器中混合气体的平均相对分子质量不变
D.密闭容器中气体密度不变
(2)根据表中数据,列式计算15.0℃时的分解平衡常数:__________________________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
(4)氨基甲酸铵分解反应的焓变△H____0,熵变△S___0(填>、<或=)。