(12分) 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A. Ba(OH)2溶液 B. BaCl2溶液 C. NaOH溶液 D. 澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
1200℃时可用反应 2BBr3(g)+ 3H2(g)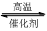 2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
2B(s) + 6HBr(g) 来制取晶体硼。完成下列填空:
(1)下列说法能说明该反应达到平衡的是______(选填序号,下同)。
a. v正(BBr3)= 3v逆(HBr) b. 2c(H2) = c(HBr)
c.密闭容器内压强不再变化 d. 容器内气体平均摩尔质量不再变化
(2)若密闭容器体积不变,升高温度,晶体硼的质量增加,下列说法正确的是_________。
a. 在平衡移动时正反应速率先增大后减小
b. 在平衡移动时逆反应速率始终增大
c. 正反应为放热反应
d. 达到新平衡后反应物不再转化为生成物
(3)若上述反应在10L的密闭容器内反应,5min后,气体总质量减少1.1 g,则该时间段内氢气的平均反应速率为__________________。
(4)往容器中充入0.2 mol BBr3和一定量H2,充分反应达到平衡后,混合气体中HBr百分含量与起始通入H2的物质的量有如图关系。在a、b、c三点中,H2 的转化率最高的是______(选填字母)。b点达到平衡后,再充入H2使平衡到达c点,此过程中平衡移动的方向为__________(填“正向”、“逆向”或“不移动”)。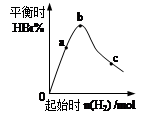
下表中所列的字母分别代表某一化学元素。完成下列填空:
| a |
|||||||||||||||||
| b |
|||||||||||||||||
| c |
d |
e |
f |
||||||||||||||
| g |
|||||||||||||||||
| h |
|||||||||||||||||
| i |
|||||||||||||||||
(1)h的最外层有____种运动状态的电子。a、b、c三种元素形成的化合物电子式为________。
(2)d单质溶于i的最高价氧化物对应水化物的溶液时发生反应的离子方程式为____________。
(3) 元素e与f元素相比,非金属性较强的是__________(写元素符号),下列表述中能证明这一事实的是__________(选填序号)。
a. e的阴离子还原性强于f的阴离子 b. f的氢化物酸性强于e的氢化物
c. e单质的熔点高于f单质 d. e和f形成的化合物中,e显正价,f显负价
(4)元素X(非a~i元素)是所在周期原子半径最大的非金属元素,它的气态氢化物为三角锥形极性分子,写出X在周期表中的位置_______________________________。
某化合物A经碱性水解后得到B,酸化后得到C(C8H8O2)。核磁共振氢谱表明,C含有苯环,且苯环上有2种氢原子。B经过下列各步反应后得到G(C8H12O4),核磁共振氢谱显示G中只有1种氢原子。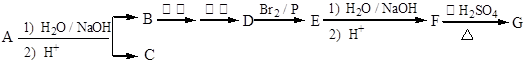
已知: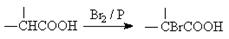
请回答下列问题:
(1)有机物类别:A物质属于______类,C物质属于________类。
(2)写出满足下列条件的C的所有同分异构体:__________________________________________。
①是苯的对位二取代化合物;②能与FeCl3溶液发生显色反应;③不考虑烯醇( )结构。
)结构。
(3)写出F→G反应的化学方程式:_____________________________________________________。
(4)写出A的结构简式:_____________________________________。
(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(仅要求写出1种):__________________________________。
F是新型降压药替米沙坦的中间体,可由下列路线合成:

(1)D→E的反应类型是_________,E→F的反应类型是__________________________。
(2) C中含有的官能团名称是_________。已知固体C在加热条件下可溶于甲醇,下列有关C→D的说法正确的是____________________。
a.使用过量的甲醇,是为了提高D的产量 b.浓硫酸的吸水性可能会导致溶液变黑
c.甲醇既是反应物,又是溶剂 d.D的化学式为C9H9NO4
(3)E的同分异构体苯丙氨酸(a-氨基-ß-苯基丙酸)经缩合反应形成的高聚物是________(写结构简式)。
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)=________mol·L-1, C的物质的量为______ mol;此时,正反应速率_____________(填“大于”、“小于”或“等于”)逆反应速率。
(2)在恒容密闭容器中判断该反应是否达到平衡的依据为________(填正确选项前的字母):
a.压强不随时间改变b.气体的密度不随时间改变
c. c(A)不随时间改变d.单位时间里生成c和D的物质的量相等
(3)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为___________________。
A(g)+B(g)的平衡常数的值为___________________。
(4)绝热容器不与外界交换能量,在恒容绝热条件下,进行2M(g)+N(g) 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
| 物质 |
M |
N |
P |
Q |
| 起始投料/mol |
2 |
1 |
2 |
0 |