酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
(1)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验。
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质。则无色溶液可能是 。
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。。请将下表填写完整。
| 实验目的 |
实验操作 |
现象 |
结论或化学方程式 |
| 除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 溶液, 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 |
向过滤后的滤液中滴入几滴酚酞试液 |
|
该样品中含有氢氧化钠 |
(2)若73 g质量分数为10%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数。
中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中 最大使用量为0.25g/L。某综合实践活动小组测定葡萄酒中 的含量,取320mL某葡萄酒(加适量稀酸),加热使 全部逸出,并将 通入足量的 溶液中发生化合反应,待完全反应后,得到含溶质质量分数为0.098%的硫酸溶液100g。请回答下列问题:
(1)从上述信息可知:当压强一定时,升高温度, 气体在水中的溶解度 。(选填“增大”、“减小”或“不变”)
(2)通过计算判断该葡萄酒中 的含量是否符合国家标准?(写出计算过程)
绵阳西北部山区石灰石资源非常丰富,大量用于生产水泥。用石灰石和砂岩黏土高温煅烧得到一种新型水泥熟料,主要反应为: 。
(1)上述反应涉及四类化合物中的哪几类? 。
(2) 的化学式可表示为 ,含 44.8%的水泥熟料中含 的质量分数为 。
(3)在实验室用如图所示方法粗略测定石灰石中 的质量分数,无需测定的数据是 (填序号)。
| A. |
取用石灰石样品的质量 |
| B. |
倒入的过量稀盐酸的质量 |
| C. |
盐酸接触样品前电子秤的读数 |
| D. |
反应停止后电子秤的读数 |
(4)用含 90%的石灰石1000t生产新型水泥熟料,理论上会排放 多少吨?(无计算过程不给分)

工业上用 溶液蚀刻铜箔制造印刷电路板,反应为 ,蚀刻废液又可再处理,实现资源回收和循环利用,其流程转化关系如图。
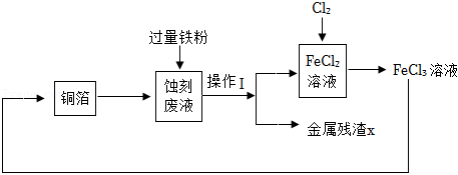
请回答相关问题。
(1)“蚀刻废液”的全部溶质有 和少量 。操作Ⅰ的名称是 。
(2)参照上述流程,画出由“金属残渣X”分离回收 和 溶液的简单流程图。
(3)上述流程中,能使三价铁转化为二价铁的物质有 。
(4)蚀刻掉128g铜,消耗 的质量为 g,理论上至少需要20% 溶液的质量为 g。(不需要写出计算过程)
如图是氧气的实验室制取与性质实验。
(1)试管口棉花的作用是 。
(2)检验氧气集满的方法是 。
(3)制取氧气的主要步骤如下,正确的顺序是 (填序号)。
①装入药品,开始加热
②停止加热
③收集气体
④组装仪器,检查气密性
(4)硫在氧气中燃烧的现象是 。
(5)根据化学方程式计算,制取0.96g氧气,至少需要高锰酸钾的质量是多少?

高速钢是制造冰鞋冰刀的重要材料,其性能与含碳量关系密切。为测试冰刀中碳元素的质量分数,现取一定质量的冰刀于烧杯中,分3次每次加入100g溶质质量分数相同的稀硫酸,实验过程和数据如图所示。请根据相关信息回答下列问题。

(1)推算图中m的数值为 。
(2)请写出第2次反应后溶液中溶质的化学式 。
(3)计算冰刀中碳元素的质量分数(不考虑杂质,结果精确到0.01%)。