工业上用 溶液蚀刻铜箔制造印刷电路板,反应为 ,蚀刻废液又可再处理,实现资源回收和循环利用,其流程转化关系如图。
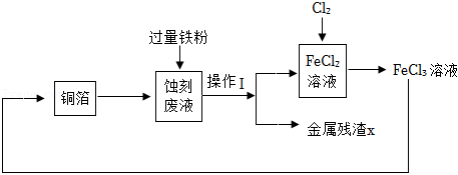
请回答相关问题。
(1)“蚀刻废液”的全部溶质有 和少量 。操作Ⅰ的名称是 。
(2)参照上述流程,画出由“金属残渣X”分离回收 和 溶液的简单流程图。
(3)上述流程中,能使三价铁转化为二价铁的物质有 。
(4)蚀刻掉128g铜,消耗 的质量为 g,理论上至少需要20% 溶液的质量为 g。(不需要写出计算过程)
根据如图回答问题。

(1)A中集气瓶内水的作用是 。
(2)B中集气瓶内水位最终约在刻度 处。
(3)C中制备氧气的化学方程式是 。
(4)D中若加入的固体是NH 4NO 3,实验现象是 。
(5)E中探究可燃物燃烧的条件之一是 。
A、B、C、D、E分别表示初中化学常见的五种物质,它们的部分反应和转化关系如图所示("﹣"表示两种物质能发生反应,"→"表示一种物质能转化成另一种物质,且省略部分反应物或生成物及条件),已知其中只有两种物质是氧化物,E是含有三种元素的物质。
(1)若D为水时,且A、B两物质能发生化合反应,请回答:
①写出A、E物质的化学式:A 、E ;
②A与B发生反应的现象为 。
(2)若D为二氧化碳时,请回答:
①写出A、C物质的化学式:A 、C ;
②按照图示所标明的物质关系,写出能生成空气污染物的化学反应方程式 。

如图是氢气和氧气发生反应的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)A图所示物质属于 (填物质分类),从微观角度说明理由是 ;
(3)画出比氧元素多一个周期少一个族的元素的原子结构示意图 .

碱式碳酸锌[Zn x(OH) y(CO 3) z]是制备功能材料ZnO的原料,其化学反应表达式为:Zn x(OH) y(CO 3) z  ZnO+CO 2↑+H 2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):
ZnO+CO 2↑+H 2O(x、y、z为正整数)。小金设计了图甲所示装置对碱式碳酸锌的组成进行探究(装置气密性良好,药品足量,实验操作正确):

(1)图甲中装置B的作用是 。
(2)查阅资料发现,在不同温度条件下充分加热等质量的碱式碳酸锌样品,剩余固体的质量与加热温度的关系如图乙所示。实验中加热时,热分解装置的温度至少要达到 ℃(选填"200"、"300"或"400")。
(3)部分实验步骤为:"……加热前先通入N 2排尽装置内的空气,关闭通入N 2的活塞,……控制一定温度下加热……"。实验过程中可根据 现象判断碱式碳酸锌样品已反应完全。
(4)小金取54.7g碱式碳酸锌样品(不含杂质),放置于热分解装置内,完全反应后测得装置A增重5.4g,装置B增重8.8g。则x:y:z的最简整数比为 。
今年5月,运用"蓝鲸一号"钻探平台,我国南海神狐海域首次实现可燃冰试采成功.
材料一:可燃冰、学名天然气水化合物,其化学式为CH 4•8H 2O.它是天然气的固体状态(因海底高压).埋于海底地层深处的大量有机质在细菌的分解作用下,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温(2~5℃)与压力下结晶,形成"可燃冰".
材料二:"蓝鲸一号"钻探平台设计和建造过程刷新了多项世界纪录,它长117米,宽92.7米,高118米,质量为42000吨.
请根据上述材料回答:
(1)形成可燃冰需要一定的生态环境.
①海底地层深处,这些分解有机质的细菌能很好的生存,体现了生物对环境的 .这些细菌分解有机质 (选填"需要"或"不需要")氧气,这些细菌与真菌在细胞结构上的主要区别是 .
②在开采过程中,极少量的垃圾废弃物没有对海洋环境造成破坏,这主要是因为海洋生态系统有 的能力.
(2)形成可燃冰的其中一个条件是有甲烷气源.
①可燃冰(CH 4•8H 2O)中C:H:O的元素质量比是 ,甲烷属于 (选填"有机物"或"无机物").
②与石油、煤等化石燃料相比较,开采可燃冰的积极意义有(写一条) .(可燃冰在空气中燃烧的化学方程式为CH 4•8H 2O+2O 2  CO 2+10H 2O)
CO 2+10H 2O)
(3)如果南海海水的密度是1.03×10 3千克/米 3,"蓝鲸一号"钻探平台漂浮海面受到海水浮力是 牛,浸入海水的体积至少需要 米 3,开采出的可燃冰可以直接在管口点燃,说明已经成为气体,从固体变成气体的原因可能是 .