下列有关实验原理、方法和结论都正确的是
| A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
| B.取少量溶液X,向其中加入适量新制氨水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 |
D.已知I-3 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
下列各组离子,在强碱性溶液中可以大量共存的是()
A. 、 、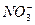 、 、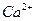 、 、 |
B. 、 、 、 、 、 、 |
C. 、 、  、 、 、 、 |
D. 、 、 、 、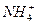 、 、 |
下列反应的化学方程式或离子方程式与反应物之间的相对量的多少无关的是()
| A.碳酸钠溶液与盐酸 | B.氢氧化钡溶液与稀硫酸 |
| C.碳酸氢钠溶液与澄清的石灰水 | D.硝酸银溶液与氨水. |
下列反应中,氧化剂与还原剂的物质的量之比为2 :1的是()
| A.Zn + 2HCl = ZnCl2 + H2↑ |
| B.Cu +2 H2SO4(浓) = CuSO4 + SO2↑+ 2H2O |
| C.3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O |
| D.2Na + Cl2 = 2NaCl |
NA为阿伏加德罗常数,下列说法正确的是()
| A.标况下,22.4 L水中含有NA个H2O分子 |
| B.14 g N2含有的核外电子总数为NA |
| C.1 mol乙烯中含2 NA个碳碳双键 |
| D.2.3 g金属钠与足量水反应时失去的电子数是0.1NA |
下列说法合理的是()
| A.既能与酸反应又能与碱反应的物质一定是两性物质 |
| B.焰色反应属于元素的物理性质 |
| C.物质的氧化性就是非金属性,是得电子的性质,物质的还原性就是金属性,是失电子的性质 |
| D.已知铝与氢氧化钠溶液反应为: 2Al +2NaOH +2H2O =" 2" NaAlO2 + 3H2↑ |
由化学方程式便知,铝是还原剂,水和氢氧化钠是氧化剂