科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在溶积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);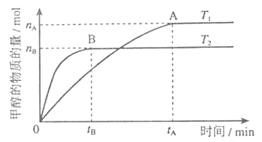
下列说法正确的是________(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)= 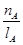 mol·L-1·min-1
mol·L-1·min-1
②该反应在T时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1、02 |
2、27 |
0、74 |
1、43 |
0、77 |
1、10 |
0、99 |
1、86 |
0、75 |
1、17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是:。(写元素符号)。比元素B原子序数大10的元素其基态原子的核外电子排布式是。
(2)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形成个σ键,个π键。
(3)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第族。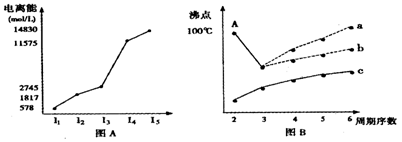
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第族元素氢化物的沸点的变化规律。
②不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是,理由是。
下图转化关系中,化合物B既能使溴的CCl4溶液褪色,又能与NaHCO3溶液反应生成无色气体;D、E均为高分子化合物;已知一个碳原子同时连接两个羟基的结构不稳定。根据下图填空: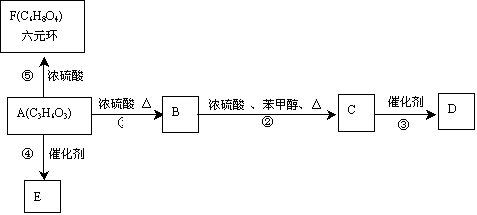
(1)A的结构简式是 ;B中含有官能团名称是 ;
(2)反应③的化学方程式是 ;
(3)反应①的反应类型是 ;
(4)高分子化合物E可作为可降解塑料,E的结构简式是 ;
研究NO2、SO2、CO等大气污染气体的处理有重要意义。
(1)NO2可用水吸收,相应的化学方程式为______。
利用反应6NO2+8NH3 7N2+12H2O
7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+ O2 (g)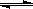 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 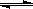 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) 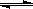 SO3 (g) +NO(g)△H =______kJ·mol-1
SO3 (g) +NO(g)△H =______kJ·mol-1
一定条件下,将体积比为1:2的 NO2和 SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g) 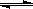 CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。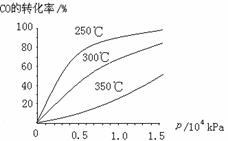
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: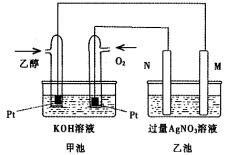
(1)M电极的材料是 ,电极名称是 ,N的电极反应式为 ,通入乙醇的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为 。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
A、B两种有机物均是有机合成的中间体,其中A的分子式为C4H7O2Br,B分子中含2个氧原子,其燃烧产物n(CO2) : n(H2O)=2:1, B的相对分子质量为188。A和B存在如下转化关系: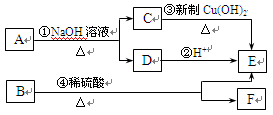
已知:①一个碳原子上连有两个羟基时,易发生下列转化: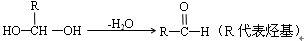
②同一个碳原子上连有两个双键的结构不稳定。
请回答:
(1)A的结构简式是。
(2)B的化学式是。
(3)写出下列反应的化学方程式
反应①;
反应③。
(4)F具有如下特点:①具有弱酸性;②可以形成五种一氯代物,其中苯环上只有两种;④除苯环外,不含有其他环状结构。写出符合上述条件且具有稳定结构的任意两种同分异构体的结构简式:、。