6—羰基庚酸是合成某些高分子材料和药物的重要的中间体。某实验室以溴代甲基环己烷为原料合成6—羰基庚酸,请用合成反应流程图表示出最合理的合成方案(注明反应条件)。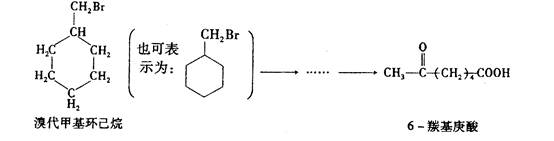

提示:①合成过程中无机试剂任选②如有需要,可以利用试卷中出现过的信息
③合成反应流程图表示方法示例如下:
下图为向100 mL 2 mol/L AlCl3溶液中加入2 mol/L NaOH溶液过程中,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。试回答:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为1∶。
(2)AB段曲线所表示的反应的离子方程式是___________________。
(3)B点对应溶液中存在的物质的量浓度最大的离子是(填离子符号);若向B点对应溶液中通入二氧化碳气体,可见到的现象是。
(4)当该AlCl3溶液中产生7.8 g沉淀时,消耗2 mol/L NaOH溶液的体积可能是多少?(写计算过程)
铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是________(用字母代号填)。
A.FeB.FeCl3C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是________nm。
(3)电子工业需要用30 %的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式。某同学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少量待测溶液,滴入KSCN溶液呈红色,则溶液中所含金属阳离子有___________。
(4)若要验证该溶液中含有Fe2+,正确的实验方法是(用字母代号填)。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废液中回收铜,并重新获得FeCl3溶液设计实验方案如下: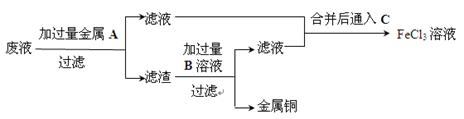
①写出上述实验中有关物质的化学式:
A:_____________;B:。
②写出通入C的化学方程式__________________________________。
下图是由常见元素组成的一些单质及其化合物之间的转化关系图。常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑浊;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色。A是一种常见的氮肥,F也能由A直接分解可得到。C、G、K的焰色反应呈黄色。(反应中部分生成物质已略去)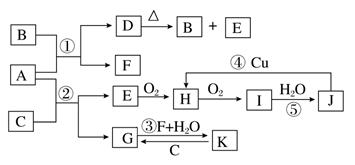
请回答下列问题:
(1)物质D的化学式为,其水溶液中阳离子的检验方法(文字表述)。
(2)写出反应③的化学方程式________________________。
(3)写出反应④的离子方程式________________________。
(4)写出反应⑤的化学方程式,并用双线桥标出电子转移的方向和数目______________________________。
(12分)某无色溶液中只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-、NO3-,已知该溶液能与铝反应且放出的气体只有氢气。试回答下列问题:
(1)若反应后生成Al3+,反应的离子方程式为________________,则原溶液中一定大量存在的离子有________________,一定不能大量存在的离子有__________________。
(2)若反应后生成AlO2-,反应的离子方程式为,则溶液中一定大量存在的离子有,一定不能大量存在的离子有。

(1)B的化学式_____________,D的电子式_____________。
(2)D在一定条件下也可直接生成H,写出离子方程式 。
(3)写出E转化为G的化学方程式。