(1)常温下,向20 mL 0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
①当V(NaOH)=20mL时,溶液中离子浓度的大小关系: ___________________;
②等体积、等物质的量浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水_________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入___________。
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是__________(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:如果将反应温度提高到T2,Ru催化分解初始浓度为c0的氨气过程中α(NH3)—t的总趋势曲线(标注Ru—T2)
③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=_____________。
(14分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑2NO2 N2O4)。
N2O4)。
(1) 硝酸在该反应中表现的性质是__________________。
(2) 0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为____________;所得溶液(假设溶质不扩散)的物质的量浓度是___________ 。
(3) 如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式______。
(4) 如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____。
某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入相同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与相同浓度的硫酸铜溶液在短时间内不反应的原因可能是______(填序号)。
A.铝与Cl-反应,铝与SO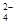 不反应
不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是________。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是__________________________________.
(4)某同学通过其他的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是________。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
在下列①~⑩中选出适宜的词语填入下列每小题的空格中(填编号):
①渗析②盐析③聚沉④溶胶⑤凝胶⑥布朗运动⑦电泳⑧丁达尔现象 ⑨中和⑩水解
(1)肥皂水中透过强光,可以见到光亮的“通路”。这种现象称为___________。
(2)在制取肥皂时,加入食盐细粒使肥皂析出,这个过程称为_____________。
(3)在肥皂水中滴加酚酞,溶液变成红色,说明高级脂肪酸根离子发生了______________。
(4)在氢氧化铁胶体中加入浓硫酸铵溶液,产生红褐色沉淀,这种现象叫做____________。
(5)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做___________。
慢心律是一种治疗心律失常的药物,它的合成路线如下: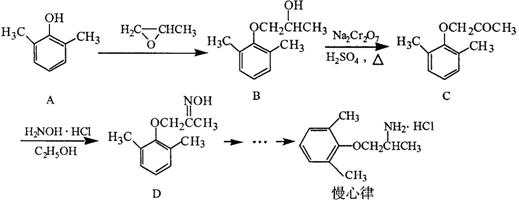
(1)由B → C的反应类型为。
(2)B分子中有2个含氧官能团,分别为和(填官能团名称)。
(3)写出A与浓溴水反应的化学方程式。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:。
①属于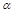 -氨基酸;
-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有一种。
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷。
完成以邻甲基苯酚(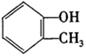 )和乙醇为原料制备
)和乙醇为原料制备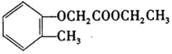 的合成路线流程图。
的合成路线流程图。
①结合题中信息;无机试剂任用。
②合成路线流程图中,在( )填反应条件,在[ ]填反应物或生成物的结构简式: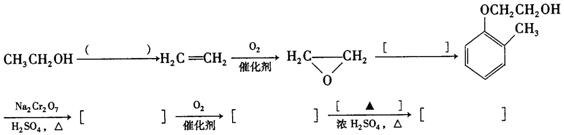
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。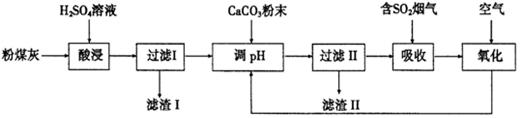
(1)酸浸时反应的化学方程式为;滤渣I的主要成分为(填化学式)。
(2)滤渣Ⅱ的主要成分为(填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为;氧化后循环利用的溶液的pH将(填“增大”、“减小”或“不变”)。