(本题共12分)合成尿素的反应为:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g)+Q(Q>0)。一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中气体的密度为4.2 g/L。
CO(NH2)2(s)+H2O(g)+Q(Q>0)。一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中气体的密度为4.2 g/L。
完成下列填空:
23.平均反应速率υ(NH3)=____________。
24.下列描述中能说明上述反应已达平衡的是_________(填序号)。
a.2υ正(NH3)=υ逆(H2O)
b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变
d.气体的压强不再发生变化
25.为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______(填序号)。
a.200℃ b.800℃ c.101 kPa d.24000 kPa
26.上述反应所涉及的4种元素中,原子半径从大到小的排列顺序为_________;原子核外有2个未成对电子的元素是________;反应所涉及的化合物中仅有一种是非极性分子,其电子式为_____________。
27.下列能用于判断氮、碳两种元素非金属性强弱的是________(填序号)。
a.气态氢化物沸点 b.最高价氧化物对应水化物酸性强弱
c.HCN中,碳为+2价 d.单质晶体类型
(1).切开钠的断面呈____色,有____光泽,能用小刀切割,表明钠的硬度____.
金属钠____导电,密度____,熔 点_____
点_____
.(2).切开的光亮的金属钠断面在空气中会______,原因是____________________,反应的化学方程式为__________,若金属钠在空气中燃烧,则 生成的是_____________,燃烧时火焰呈______色,反应的化学方程式_________________.
生成的是_____________,燃烧时火焰呈______色,反应的化学方程式_________________.
(3)..将一小块金属钠投入水中,反应的化学方程式为_______,其中____是还原剂,_______是氧化剂.
.如下图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答: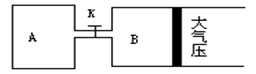
(1)B中X 的转化率α(X)B为
(2)A中W和B中Z的物质的量的比较:n(W)An(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为升(用a表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是。
(10 分)(1)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的P亚层上有3个电子。
①写出甲元素的电子排布式________________________;
②甲、乙元素的第一电离能关系为甲乙(填>、<、=);两元素可形成硬度大于金刚石的一种化合物,该化合物属于______晶体,其化学式为_____________,若使其熔化,需破坏的作用关系为___________________.
(2)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物,其中一类是含Mo、Fe、S原子的类立方体结构,如下图所示:图中左右两边对称,各含一个近似为立方体的结构,每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一个化学键。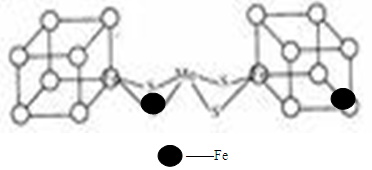
①请在图中左边立方体的○中填写出(在○涂黑)其余3个Fe原子
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为______
(10分) 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):[来
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):[来
(1)放电时 :正极的电极反应式是;电解液中H2SO4的浓度将________(填变大、变小、不变);当外电路通过1 mol电子时,理论上负极板的质量增加________g。
:正极的电极反应式是;电解液中H2SO4的浓度将________(填变大、变小、不变);当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成_____、B电极上生成_____________,此时铅蓄电池的正负极的极性将________________。
用KMnO4氧化密度为1.19g/cm3,溶质质量分数为36.5%的盐酸。反应方程式如下:
2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
+ 8H2O
(1)15.8g KMnO4能与gHCl发生上述反应,其中有gHCl被氧化。
(2)产生的Cl2在标准状况下的体积为。