以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O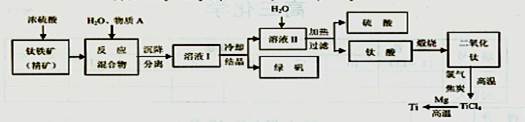
回答下列问题:
(1)钛铁矿和浓硫酸反应属于________(选填“氧化还原反应”或“非氧化还原反应”);
(2)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由 ;
(3)上述生产流程中加人物质A的目的是防止Fe2+被氧化,物质A是____,上述制
备TiO2的过程中,所得到的副产物及可回收利用的物质是 。
(4)钛、氯气和过量焦炭在高温下反应的化学方程式 ;
(5)如果取钛铁矿At,生产出钛Bt(不考虑损耗),则钛铁矿中钛的质量分数____(用A、B字母表示)。
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,设计了如下图所示的实验装置,试按要求回答问题。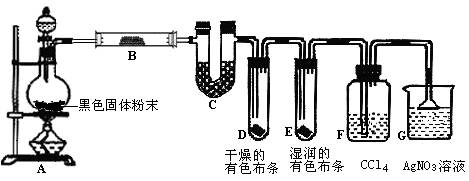
(1)写出装置A中反应的离子方程式_______________________________________;
(2)①装置B中盛放的试剂名称为,装置C的作用是;
②装置D和E中出现的不同现象说明的问题是;
(3)F装置的作用是;
(4)若装置G中出现白色沉淀,该实验现象能否说明A中制备出的Cl2中含有HCl气体
(填“能”或“不能”)。
几种中学化学常见的单质及其化合物相互转化的关系图如下:
 |
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1:2,元素质量之比为7:8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为 ,每反应1mol的A转移的电子数为 mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式: ;
(3)少量F的饱和溶液与分别滴加到下列物质中,得到三种分散系①、②、③。
 |
试将①、②、③填入下列方框中:
 |
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式: ;
(5)已知丙单质与D的浓溶液按物质的量为1:2恰好反应生成B气体的化学转化式为:
丙 + D(浓) B↑+ 丙的氧化产物 + 水
B↑+ 丙的氧化产物 + 水
则丙在其氧化产物中的化合价为: 。
现有某金属的硝酸盐2.160g,充分加热分解生成金属氧化物0.960g和NO2、O2的混合气体0.0270mol(不考虑N2O4).请填空:
(1)混合气体中NO2的物质的量为________mol.
(2)将此组成的混合气体通入足量水中,剩余气体在标准状况下体积为________mL.
(3)该反应中金属元素的化合价________(填升高、降低、不变).
(4)写出该硝酸盐分解的化学方程式,标明电子转移的方向和数目.
同位素示踪法是用同位素作为一种标记,制成含有同位素的标记化合物代替相应的
非标记化合物进行化学反应,然后用核探测器随时追踪它在反应产物中的存在形式来确定反应的原理等。
氧化还原反应氧化剂与还原产物、还原剂与氧化产物之间的内在关系也可以利用同位素失踪法进行验证。
(1)H2O2与H2SO4酸化的KMnO4反应,生成K2SO4、MnSO4、H2O和O2,如果H2O2中氧原子是示踪原子(18O),
反应完成后含有示踪原子的物质是________________。
(2)K35ClO3晶体和含有H37Cl的浓盐酸反应生成氯气,已知反应方程式为KClO3+6HCl(浓)= KCl+3Cl2↑+
3H2O,此反应生成氯气的摩尔质量为________________。
(3)某反应体系中共有6种物质,KClO3、KCl、HCl、Cl2、ClO2、H2O,请你设计同位素失踪法确定反应
的方程式并配平:
将磷肥生产中形成的副产物石膏(
)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除
、
外,还需要等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除
外还含有(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是
溶液。检验滤液中含有
的方法是
(5)已知不同温度下
在100
水中达到饱和时溶解的量如下表:
| 温度(℃) |
0 |
20 |
60 |
|
溶解的量(
) |
7.4 |
11.1 |
18.2 |
60℃时 的饱和溶液591 冷却到0℃,可析出 晶体
(6)氯化钙结晶水合物(
)是目前常用的无机储热材料,选择的依据是
a熔点较低(29℃熔化) b能导电 c能制冷 d无毒
(7)上述工艺流程中体现绿色化学理念的是:。