分类方法是研究物质和化学反应的重要方法。
(1)对HCl(盐酸)、H2SO4(硫酸)、HNO3(硝酸)、H3PO4(磷酸)、H2S(氢硫酸)进一步分类时有多种分类角度,请你自定标准进行分类。
分类标准是 ,与HCl同属一类的是 。
(2)根据物质的树状分类,PH3的物质类别是 。
A. 磷酸盐 B. 磷化物 C. 氢化物
(3)氧化钙、氢氧化钙分别与盐酸反应的共同点是 ,由此可得出氧化钙属于碱性氧化物。根据上述信息的启示,N2O5与氢氧化钠溶液反应的离子方程式是 。
碳和氮的化合物与人类生产、生活密切相关。
(1)C、CO、CO2在实际生产中有如下应用:
a.2C + SiO2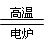 Si + 2CO b.3CO + Fe2O3
Si + 2CO b.3CO + Fe2O3 2Fe + 3CO2
2Fe + 3CO2
c.C + H2O CO + H2 d.CO2 + CH4
CO + H2 d.CO2 + CH4 CH3COOH
CH3COOH
上述反应中,理论原子利用率最高的是。
(2)有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为搞清该方法对催化剂的影响,查得资料:
则:① 不用通入O2氧化的方法除去CO的原因是。
② SO2(g) + 2CO(g) =" S(s)" + 2CO2(g) △H =。
(3)汽车尾气中含大量CO和氮氧化物(NO )等有毒气体。
)等有毒气体。
①活性炭处理NO的反应:C(s)+2NO(g) N2(g)+CO2 (g) ∆H=-a kJ·mol-1(a>0)
N2(g)+CO2 (g) ∆H=-a kJ·mol-1(a>0)
若使NO更加有效的转化为无毒尾气排放,以下措施理论上可行的是:。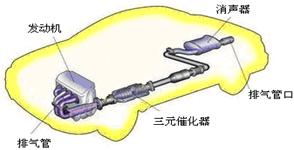

a.增加排气管长度 b.增大尾气排放口
c.添加合适的催化剂 d.升高排气管温度
②在排气管上添加三元催化转化装置,CO能与氮氧化物(NO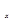 )反应生成无毒尾气,其化学方程式是。
)反应生成无毒尾气,其化学方程式是。
(4)利用CO2与H2反应可合成二甲醚(CH3OCH3)。以KOH为电解质溶液,组成二甲醚空气燃料电池,该电池工作时其负极反应式是。
(5)电解CO制备CH4和W,工作原理如图所示,生成物W是,其原理用电解总离子方程式解释是。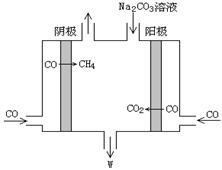
(15分)二氧化碳的过度排放会引发气候问题,而进行有效利用则会造福人类,如以CO2和NH3为原料合成尿素。经研究发现该反应过程为:
①CO2(g)+2NH3(g) NH2COONH4(s)△H1
NH2COONH4(s)△H1
②NH2COONH4(s) CO(NH2)2(s)+H2O(g)△H2>0
CO(NH2)2(s)+H2O(g)△H2>0
请回答下列问题:
(1)研究反应①的平衡常数(K)与温度(T)的关系,如图1所示,则△H1____0。(选填“>”、“<”或“=”)。
(2)有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图2所示,现将3molNH3和2molCO2放入容器中,移动活塞至体积V为3L,用铆钉固定在A、B点,发生合成尿素的总反应如下:
CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)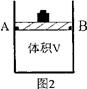
测定不同条件、不同时间段内的CO2的转化率,得到如下数据:
| CO2的转化率T(℃) |
10min |
20min |
30min |
40min |
| T1 |
30% |
65% |
75% |
75% |
| T2 |
45% |
50% |
a1 |
a2 |
①T1℃下,l0min内NH3的平均反应速率为__________。
②根据上表数据,请比较T1_________T2(选填“>”、“<”或“=”);T2℃下,第30min时,a1=________,该温度下的化学平衡常数为_________。
③T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通人3molCO2,此时v(正)_____v(逆)(选填“>”、“<”或“=”),判断的理由是______。
(3)请在下图中补画出合成氨总反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、生成物CO(NH2)2(s)+H2O(g)〕。
CO(NH2)2(s)+H2O(g)过程中能量变化图,并标明中间产物〔NH2COONH4(s)〕、生成物CO(NH2)2(s)+H2O(g)〕。
(18分)
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构。2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色。
(1)镁与气体X反应产物的电子式为________。
(2)浓硝酸和浓盐酸反应的化学方程式为________。
(3)化合物M水解生成两种酸,为非氧化还原反应,该反应的化学方程式为________。
Ⅱ.石油铁储罐久置未清洗易引发火灾,经分析研究,事故由罐体内壁附着的氧化物甲与溶于石油中的气态氢化物乙按1:3反应生成的黑色物质丙自燃引起。某研究小组将一定量的丙粉末投人足量的浓盐酸中发生反应,得到4.8g淡黄色沉淀和气体乙,乙在标准状况下的密度为1.5179g/L,过滤后向滤液(假设乙全部逸出)中加人足量的NaOH溶液,先出现白色沉淀,最终转变为红褐色沉淀,过滤、洗涤、灼烧后的固体质量为24g,已知气体乙可溶于水。请回答下列问题:
(1)甲的化学式为________。
(2)写出丙中非金属元素的离子结构示意图________。
(3)丙在盐酸中反应的化学方程式:________。(离子方程式表示)
(4)请设计合理的实验方案验证不同温度对丙与盐酸反应速率的影响
(5)为消除火灾隐患,下列措施可行的是________。
| A.石油入罐前脱硫 |
| B.定期用酸清洗罐体 |
| C.罐体内壁涂刷油漆 |
| D.罐体中充入氮气 |
(10分)以苯为原料合成高分子化合物I的路线如下:
已知有机物的化学性质主要由官能团决定。请回答下列问题:
(1)含有的官能团名称为______;I的结构简式为____。
(2)写出A→B反应的化学方程式:___________;E+F→G的反应类型为____。
(3)写出H与NaOH溶液在加热条件下反应的化学方程式____。
【化学—选修3:物质结构与性质】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅,还有铜铟镓硒等化合物。
(1)镓的基态原子的电子排布式是_____________。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为______用元素符号表示)。
(3)气态SeO3分子的立体构型为______________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________________________________________。
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为________。
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应生成铜氨配离子的溶液,则该反应的离子方程式为____________________。
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。