一定质量的铜和足量的浓硝酸或稀硝酸完全反应,在相同条件下用排水集气法收集产生的气体。下列叙述正确的是
①硝酸 浓度越大,消耗的硝酸越少
浓度越大,消耗的硝酸越少
②硝酸浓度不同,生成的Cu (NO3)2的物质的量相同
(NO3)2的物质的量相同
③硝酸浓度越大,产生的气体越少
④用排水集气法收集到的气体在相同状况下体积相同
| A.只有② | B.②④ | C.①③ | D.②③ |
某烷烃含200个氢原子,则该烃的分子式是
| A.C97H200 | B.C98H200 | C.C99H200 | D.C100H200 |
下列反应属于取代反应的是
| A.CH4C+2H2 |
| B.2HI+Cl2===2HCl+I2 |
| C.CH4+2O2CO2+2H2O |
| D.CH4+Cl2CH3Cl+HCl |
以下实验方案合理的是
| A.为了提高甲烷与氯气的反应速率,用阳光直射反应容器 |
| B.为了验证甲烷与氯气的反应产物之一为氯化氢,水槽中改用AgNO3溶液 |
| C.用溴水鉴别乙烷和乙烯 |
| D.用高锰酸钾溶液除去乙烷中的乙烯 |
能证明乙醇分子中含有一个羟基的事实是
| A.乙醇完全燃烧生成水 |
| B.乙醇容易挥发 |
| C.乙醇能与水以任意比例互溶 |
| D.0.1mol乙醇与足量金属钠反应生成0.05molH2 |
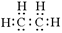 下列有关说法正确的是
下列有关说法正确的是
| A.乙烯的电子式为: |
| B.乙烯与溴发生加成反应生成1,1—二溴乙烷 |
| C.由乙烯分子的组成和结构推测含一个碳碳双键的单烯烃分子式通式为CnH2n |
| D.乙烯在空气中燃烧的现象与甲烷不同,原因是乙烯分子中含碳原子个数比甲烷多,所以燃烧不充分 |