钢铁暴露在潮湿的空气中会发生析氢腐蚀或吸氧腐蚀,发生吸氧腐蚀时正极反应式为 ( )
| A.4H++ 4e-= 2H2↑ | B.2H2O+O2+ 4e一 =4OH- |
| C.2Fe一 4e- =2Fe2+ | D.4OH一—4e一=2H2O+O2↑ |
下列有关物质性质的比较正确的是
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
| A.①③ | B.②④ | C.③⑥ | D.⑤⑥ |
把M mol H2和N mol C2H4混合, 在一定条件下使它们一部分发生反应生成W mol C2H6, 将反应后所得的混合气体完全燃烧, 消耗氧气的物质的量为( )
| A.M + 3N mol | B.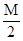 + 3N mol + 3N mol |
C.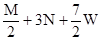 mol mol |
D. mol mol |
恒温恒容的容器内,不可作为可逆反应I2(g)+H2(g) 2HI(g)达到平衡状态的标志的是
2HI(g)达到平衡状态的标志的是
| A.1 mol H—H键断裂,同时有2 mol H—I键断裂 | B.容器内气体的总压强不再变化 |
| C.H2的物质的量浓度不再变化 | D.混合气体的颜色不再变化 |
下列有关同分异构体数目的叙述中,不正确的是( )
| A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
| B.分子式符合C5H11Cl的化合物有6种 |
| C.已知二氯苯有3种同分异构体,则四氯苯的同分异构体的数目为3种 |
D.菲的结构简式为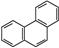 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
下列各实验,不可能成功的是()
①蒸馏普通酒精制无水乙醇;②苯与浓硫酸混合加热至60℃制硝基苯;
③用苯和溴水混合制溴苯;④用裂化汽油从碘水中提取碘
| A.只有①和④ | B.只有②和③ | C.只有①和③ | D.①②③④ |