【化学——选修2:化学与技术】
自来水生产的流程示意图见下: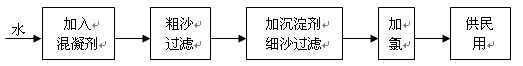
(1)混凝剂除去悬浮物质的过程 (填写序号)
①只是物理变化 ②只是化学变化 ③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成 沉淀。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加 后加 ,原因是 。
(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。
Cl2+H2O  HCl+HClO K=4.5×10-4
HCl+HClO K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
。
下列物质中, 可以作为氯气的代用品(填写序号)。
① 臭氧 ②NH3(液) ③K2FeO4 ④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有 离子交换树脂和 离子交换树脂的离子交换柱(填“阴”或“阳”,阳离子交换树脂为HR型,阴离子交换树脂为R’OH型)。
(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32- =2I-+S4O62-
则水中的溶解氧量为 mg·L-1。
如果a g 某气体中含有b个分子,则c g该气体在标准状况下的体积是 L。
若ag CO2含b个原子,则阿伏加德罗常数的值为______________
等质量的O2和O3所含的分子数之比为____________, 所含原子数之比是_______________.
乙醛的化学性质与甲醛相似,试写出有关乙醛的化学反应方程式,并注明反应类型。
(1) 乙醛与氢气在镍作催化剂,加热条件下的反应
_________________________________________________,________________
(2) 乙醛与新制氢氧化铜悬浊液加热条件下的反应
_______________________________________________,_________________;
(3) 乙醛蒸气在足量氧气中充分燃烧
_______________________________________________,_________________。
A的水溶液可用来浸制生物标本,如果乙醇中含B,饮用后会使人眼睛失明,甚至死亡,D是一种有香味的物质。下面是A、B、C、D 相互转化的关系图,请回答下列各题: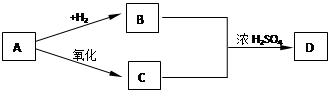
(1)请写出A、B、C、D的结构简式
A____________,B____________,C__________,D____________。
(2)A→B的化学方程式__________________________________,反应类型__________
(3)A→C的化学方程式__________________________________,反应类型__________
(4)生成D的化学方程式________________________________,D的名称_____________
(5)上述物质中能发生银镜反应的有____________,________________,________________。