(12分)根据要求完成下列问题:
(1)分析下列物质的物理性质,判断其晶体类型:
A、固态时能导电,能溶于盐酸;B、能溶于CS2,不溶于水;C、固态、液态时均不导电,熔点3500℃
A、 B、 C、
(2)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:_________、__________、_________。
(3)在H2、SiC、CO2、HF中,由极性键组成的非极性分子是 ,由非极性键形成的非极性分子是 ,能形成分子晶体的化合物是 ,含有氢键的晶体的化学式 ,属于原子晶体的是 ,四种物质熔点由高到低的顺序是 。
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色迅速变为灰绿色,最终转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
(1)则各物质的化学式为:A、B、C、D。
(2)现象②中所发生的反应的化学方程式为:
、。
(3)现象③中所发生反应的离子方程式为:
、。
Ⅰ.近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,长伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+___K2Cr2O7+__H2SO4(稀)→___CO2↑+__K2SO4+Cr2(SO4)3+__ ___
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂______,还原剂______。
(3)硫酸在上述反应中表现出的性质是____________(填选项编号)。
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
上述反应若产生11克气体物质,则转移电子的数目___________。
Ⅱ.X元素的原子核外有2个电子层,其中L层有5个电子,该元素在周期表中的位置为________,最高价氧化物的化学式为________,该元素的氢化物和最高价氧化物对应水化物反应的化学方程式为________________________________.
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
请回答下列问题:
(1)写出B中含氧官能团的名称_____________。
(2)既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有___________(用A、B、C、D填空)。
(3)按下图,C经一步反应可生成E,E是B的同分异构体,则反应①属于_________反应(填反应类型名称)。
(4)同时符合下列两项要求的D的同分异构体有4种:
①化合物是1,2-二取代苯;
②苯环上的两个取代基分别为羟基和含有-COO-结构的基团
其中两种(G和H)结构简式如下图所示,请补充另外两种。 __________________、_________________。
__________________、_________________。
(5)写出H与足量NaOH溶液共热反应的化学方程式。
钠及其化合物具有广泛的用途。
(1)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如图:
负极电极反应式为,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。
(2)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________(填离子符号),根据表中数据,浓度均为0.01mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCNB.HClO C.CH3COOHD.H2CO3
(3)实验室中常用NaOH来进行洗气和提纯。
当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为______________________________________。几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,_______(填离子符号)先沉淀,
Ksp[Fe(OH)2]Ksp[Mg(OH)2](填“>”、“=”或“<”)。
一定条件下向容积为20 L的密闭容器中充入1 mol NO2气体,发生反应2NO2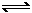 N2O4。反应中测得相关数据如下表所示:
N2O4。反应中测得相关数据如下表所示:
| 反应时间/min |
0 |
10 |
20 |
30 |
40 |
50 |
| 气体相对分子质量 |
46 |
57 |
64 |
69 |
69 |
69 |
(1)此条件下该反应的化学平衡常数Kc=________。(填表达式)
(2)在50 min末,向容器中加入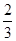 mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
(3)若保持容器体积不发生变化,升高温度,则可得如图图像,据此判断该反应ΔH________0(填“大于”、“小于”或“等于”)。
(4)若在体积不变的情况下,开始充入0.5 mol N2O4,则达到新平衡时N2O4的转化率α=________。