某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化
B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是由此造成的测定结果(偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度(保留四位小数)mol/L
实验室中有一未知浓度的稀盐酸,某学在实验室中进行测定盐酸浓度的实验,请完成下列填空。
(1)配制100 mL 0.10 mol·L-1 NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶,贴上标签。
②托盘天平称量g氢氧化钠固体。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度/(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积/mL |
待测盐酸的体积/mL |
| 1 |
0.10 |
22.58 |
20.00 |
| 2 |
0.10 |
22.72 |
20.00 |
| 3 |
0.10 |
22.80 |
20.00 |
①滴定达到终点的标志是。
②根据上述数据,可计算出该盐酸的浓度约为(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
(每空2分,共16分)
Ⅰ、中学化学实验中的中和热的测定实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶液各50 mL。NaOH的浓度大于HCl的浓度作用是___________。在大小烧杯之间填满碎泡沫(或纸条)其目的是:。
Ⅱ、某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_____________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并______________________________为止。
(2)若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度。(填“无影响”、“偏高”或“偏低”)。
Ⅲ、用实验确定某酸HA是弱酸。两同学的方案是:
甲:①配制0.1 mol·L-1的HA溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱酸。
乙:①配制0.1 mol·L-1的HA溶液100 mL;配制0.1 mol·L-1的盐酸溶液100 mL
②取相同体积的0.1 mol·L-1的HA和0.1 mol·L-1的盐酸溶液分别装入两只试管,同时加入表面积大小相同的锌粒,观察现象,即可证明HA是弱酸。
(1)在两个方案的第①步中,都要用到的定量仪器是____________________。
(2)甲方案中,说明HA是弱酸的理由是测得溶液的pH______ 1(选填“>”、“<”或“=”);乙方案中,说明HA是弱酸的现象是_______。
a.装HCl溶液的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两只试管中产生气体速率一样快
某实验小组用MnO2与浓盐酸混合加热制取Cl2,并将制得的氯气与潮湿的Ca(OH)2固体反应制取少量漂白粉。实验装置如下图: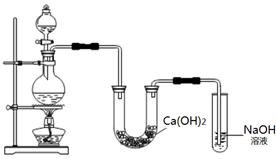
回答下列问题。
(1)漂白粉的有效成分是(写化学式)。
(2)烧瓶中发生反应的化学方程式是。
(3)温度较高时氯气与消石灰发生反应:6Cl2 + 6Ca(OH)2=5CaCl2 + Ca(ClO3)2 + 6H2O,该反应的氧化剂是,还原剂是,若反应消耗0.3mol Cl2,转移的电子数为mol。
(4)在中学化学中,常用作氧化剂的物质有、(写两种),常用作还原剂的物质有、
(写两种)。
氮的循环涉及到多种化学物质。(下图中的W、M、X、Y、Z均是化学物质)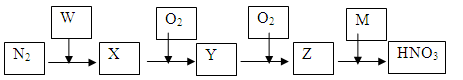
(1)由N2→X是工业合成氨的反应,写出其化学方程式。
(2)写出Y、M的化学式、。
(3)X可与HNO3反应,产物可用作氮肥,写出X与HNO3反应的化学方程式。
(4)某同学利用下图装置将氨气与氧化铜反应,验证氨气的性质并验证部分产物(部分未画出)
发现反应确实能发生,且反应后得到三种物质,其中有两种单质。
请回答下列问题:
① 实验室制取氨气的化学方程式是。
② 从氨中N元素的化合价角度看,该同学想证明的是氨的性质,实验中观察到的现象则能够证明氨具有这个性质。
③B装置的作用是。
④A中反应的化学方程式是。