氯气和二氧化硫是中学化学中常见的气体。某活动小组设计如下图所示装置图,分别研究氯气和二氧化硫的性质。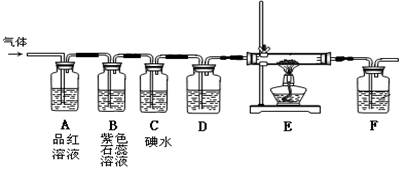
(1)下列装置常用于实验室制取气体,其中制取氯气选用的装置为 ,反应的离子方程式为 ,制取二氧化硫选用的装置为 ;
(2)从左端分别通入氯气或二氧化硫时,装置B中观察到的现象是否相同 (填“相同”或“不相同”);装置A反应后溶液均褪色,如何利用褪色后的溶液判断是何种气体使其褪色(写出简要的实验步骤) ;
(3)装置F中盛放的溶液为 ;若装置E中试剂为铁丝,则通入氯气与铁丝充分反应时现象为 ;
(4)当通入足量SO2完全反应后,向C中滴加淀粉溶液,无明显现象。该反应的离子方程式为 。
氨在人类的生产和生活中有着广泛的应用。某化学兴趣小组利用图一装置探究氨气的有
关性质。
(1)装置A中烧瓶内试剂可选用__________(填序号)。B的作用是_______。
a.碱石灰 b.浓硫酸 C.生石灰 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_______(填I或Ⅱ)。
I.打开旋塞逐滴向圆底烧瓶中加入氨水
Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为__________________________________________________。该反应证明氨气具有_________ 性。
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_________(填装置序号)。
(5)氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成0.5 L溶液,所得溶液的物质的量浓度为________________mol/L。
用0.1320 mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
| 实验编号 |
待测NaOH溶液的体积/mL |
HCl溶液的体积/mL |
| 1 |
25.00 |
24.41 |
| 2 |
25.00 |
24.39 |
| 3 |
25.00 |
22.60 |
回答下列问题:
(1)图中甲为滴定管,乙为滴定管(填“酸式”或“碱式 ”);
(2)取待测液NaOH溶液25.00 mL 于锥形瓶中,使用做指示剂,滴定终点的判断依据是;
(3)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果(填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果;
(4)该NaOH溶液的物质的量浓度为mol/L (保留小数点后四位有效数字)。
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:(注明试剂、现象)。
②检验滤液A中是否含有Fe2+的试剂是,其实验现象为。
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、(填操作名称)、洗涤。
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号)。
某班同学用如图所示的装置测定空气里氧气的含量。药匙上放少量钠,烧杯中装满水,先用弹簧夹夹住橡胶管。点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。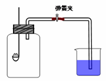
(1)写出燃烧匙中发生反应的化学方程式:,将该生成物伸入瓶底的水中,生成的氧化产物与还原产物物质的量之比为:。
(2)实验完毕,广口瓶内水面上升明显小于空气体积的1/5,对这一现象解释正确的是:
a.该同学可能未塞紧瓶塞,导致钠熄灭时外界空气进入瓶内
b.该同学可能使用钠的量不足
c.该同学可能没夹紧弹簧夹,钠燃烧时部分空气受热从导管逸出
d.该同学可能插入燃烧匙太慢,塞紧瓶塞前瓶内部分空气受热逸出
实验室用足量MnO2与浓盐酸反应制取氯气,其装置如图1所示: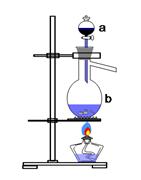

图1图2
(1)图1中仪器a的名称是:;仪器b的名称是:;b中加入碎瓷片的作用是:。
(2)请写出仪器b中发生的反应的离子方程式:
(3)检查装置的气密性之后的操作依次是:、、。(填序号)
A.向烧瓶中加入MnO2粉末
B.加热
C.向烧瓶中加入浓盐酸
(4)该反应会因为盐酸浓度下降而停止。为了测定反应残留液中盐酸的浓度,某探究小组提出下列实验方案:
①甲同学的方案为:与足量AgNO3溶液反应,称量生成沉淀的质量。
②乙同学的方案为:与足量的锌反应,测量生成气体的体积,实验装置如图2所示(夹持装置已略去)。使Y形管中的残留溶液与锌粒反应的正确操作是(“锌粒转移到残留溶液中”或“残留溶液转移到锌粒中”)。在正确读取量气管读数时,视线要平视,要注意使漏斗液面与量气管中液面相平,除此外还须注意:。
两种方案我认为(填甲或乙)同学的方案可行。