如下图表示有关物质之间的转化关系,其中X是一种正盐,Y是一种强酸,C是淡黄色固体,E是常见的金属单质.(反应①⑥⑦⑧⑨中的部分产物已略去).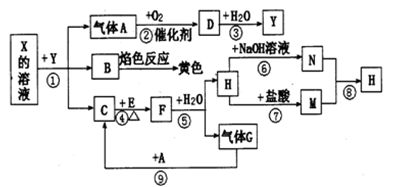
请回答下列问题:
(1)固体C的晶体类型是 ,F的化学式是 。
(2)工业上要实现A—D的转化需要的设备是 ,还需要的条件是 。
(3)在反应⑨中的氧化剂与还原剂的物质的量之比是 。
(4)反应⑧的离子方程式为 。
(5)反应①的化学方程式为 。
(6) 分别向等体积等浓度的氢氧化钠溶液和盐酸中小心加入足量的E,同温同压下产生气体体积的大小关系是 。(“前者大”“后者大”“相同”)
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列。
回答下列问题:
(1)Z的核外外围电子排布式是____________________________________________。
(2)X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为____________(填元素符号)。
(3)QR2分子中,Q原子采取________杂化,写出与QR2互为等电子体的一种分子的化学式:____________。
(4)分子式为G 2R、G 2Y的两种物质中一种更稳定,原因是_____________;T的氯化物的熔点比Q的氯化物的熔点高,原因是___________________。
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如下图所示。晶体中距每个X原子周围距离最近的Q原子有______个。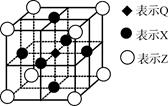
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为,该元素的符号是;
(2)Y元素原子的价层电子的轨道表示式为,该元素的名称是;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程是;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由。
A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期。A显负价时,不能被任何氧化剂氧化;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒。回答:
(1)写出五种微粒的符号:A、B、C、D、E。
(2)C的同位素名称:C2。
(3)C和D形成分子的电子式为,空间结构为。
(8分)氨的合成是最重要的化工生产之一。
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g)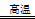 CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示:
CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示: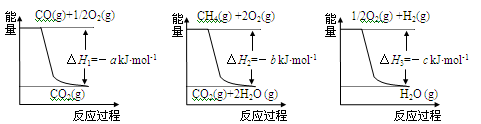
则△H4=______________(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) 2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
| 达到平衡的时间(min) |
t |
5 |
| 平衡时N2的浓度(mol·L-1) |
3 |
c |
①甲容器达到平衡所需要的时间t5min(填“>”、“<” 或“=”,下同);乙容器达到平衡时N2的浓度c3 mol·L-1。
②下图中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和 H2平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图。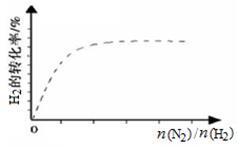
(8分)碳的化合物与人类生产、生活密切相关。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g)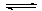 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表。
| T/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
1 |
0.8 |
0.65 |
0.6 |
0.6 |
| n(CO)/mol |
0.8 |
0.6 |
0.45 |
0.4 |
0.4 |
则该温度下反应的平衡常数K=________。
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2 molH2,此时v(正)=v(逆),则x、y的关系式是________________。
II.在一恒温、恒容密闭容器中发生反应:
Ni(s)+4CO(g) Ni(CO)4(g),△H,则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H_______(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。
Ni(CO)4(g),△H,则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H_______(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。