已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列。
回答下列问题:
(1)Z的核外外围电子排布式是____________________________________________。
(2)X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为____________(填元素符号)。
(3)QR2分子中,Q原子采取________杂化,写出与QR2互为等电子体的一种分子的化学式:____________。
(4)分子式为G 2R、G 2Y的两种物质中一种更稳定,原因是_____________;T的氯化物的熔点比Q的氯化物的熔点高,原因是___________________。
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如下图所示。晶体中距每个X原子周围距离最近的Q原子有______个。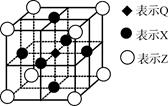
铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是(只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计的原电池,请在图甲中的横线上完成标注。
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入(填“CH4”或“O2”),b处电极上发生的电极反应式为;若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH=(假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是:
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)="0.6" moln(N2O4)=1.2mol,则此时V(正)V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点。
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序。
③d、e点对应溶液中,水电离程度大小关系是de(填“>”、“<”或“=”)。
某种盐溶解后得到的溶液中可能含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学做如下实验:
①取少量溶液于试管中.逐滴加人浓氢氧化钠溶液,发现先生成白色沉淀.迅速变为灰绿色,最后变为红揭色,并有刺激性气体生成;
②另取少量溶液于试管中,加人少量盐酸酸化的氯化钡溶液,有白色沉淀生成。该溶液中一定含有的离子是_____;
写出①中白色沉淀转化为红褐色沉淀的化学方程式:;
(2)乙同学做如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2.发现溶液变红色;继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,他查阅资料知:H2O2+SCN—→SO42—+CO2↑+N2↑+H2O+H+(SCN—中S为—2价)
①该反应中,被氧化的元素为__________,每生成1molCO2转移的电子数为___________;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+__________NCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确_____________________________________________。
(14分)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g)△H=—566kJ•moL-1
2H2(g)+O2(g)=2H2O(g)△H=—483.6kJ•moL-1
H2O(g)=H2O(l)△H=—44.0kJ•moL-1
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:___________________________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g)△H=—92.4kJ/mol
2NH3(g)△H=—92.4kJ/mol
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。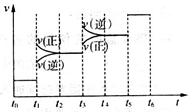
①图中t3时引起平衡移动的条件可能是__________________________________________,其中表示平衡混合物中NH3的含量最高的一段时间是_____________。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则反应在T℃时的平衡常数为____________mol-2·L2。
③目前工业合成氨的原理是: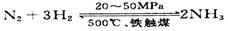
下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。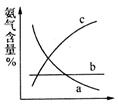
当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为_______>_______>_______>________。
(8分)某工业废水中,除H+、OH-外仅含下表离子中的几种。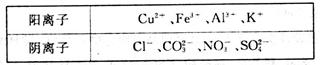
甲同学欲探究废水的组成,进行了如下实验:
I.取少量废水样品,加入KSCN溶液无明显变化。
II.另取少量废水样品,逐滴加入NaOH溶液,产生沉淀,继续滴加过量的NaOH溶液,沉淀部分溶解。
请回答下列问题:
(1)废水中一定含有的金属阳离子是___________(填离子符号)。
(2)Ⅱ中沉淀部分溶解过程中发生反应的离子方程式是____________________________。
(3)甲同学通过分析最终确定废水中一定不能大量存在上表所列四种阴离子中的________(填离子符号),其判断理由是_________________________________________。