工业生产纯碱的工艺流程示意图如下: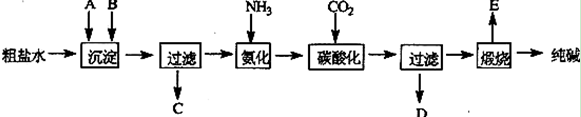
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),实验室提纯粗盐的实验操作依次为:取样、溶解、沉淀、 、蒸发、冷却结晶、 、烘干。
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是 。
碳酸化时没有析出碳酸钠晶体,其原因是 。
(3)碳酸化后过滤,滤液D最主要的成分是 (填写化学式),检验这一成分的阴离子的具体方法是: 。
(4)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰乳产生氨。加石灰水后所发生的反应的离子方程式为: 。
(5)产品纯碱中含有碳酸氢钠。取a克产品用加热分解的方法测定纯碱中碳酸氢钠的质量分数,充分加热并在干燥器中冷却得b克固体。 纯碱中碳酸氢钠的质量分数可表示为: 。
将4 mol A气体和2 mol B气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 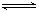 2C(g)若经2s 后测得C的浓度为0.6mol•L-1,那么,
2C(g)若经2s 后测得C的浓度为0.6mol•L-1,那么,
(1)用物质A表示的反应的平均速率为,
用物质B 表示的反应的平均速率为。
(2)2s时物质B的浓度为,
2s时物质A的转化率为 。
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。反应A:4HCl(g) +O2(g) Cl2 (g)+2H2O (g)
Cl2 (g)+2H2O (g)
已知:i.反应A中, 4mol HC1被氧化,放出115.6kJ的热量。 ii.
ii.
H2O的电子式是_______________。
反应A的热化学方程式是_______________。
③断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中
H—O 键比HCl中H—Cl键(填“强”或“弱”)_______________。
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知 N2(g)+2O2(g)="===2" NO2(g);△H="+67.7" kJ·mol-1,
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________。
(5)已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H =" +" 67.7kJ/mol
N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的
热化学方程式: ________________________________。
①CaCO3=" CaO" + CO2ΔH=+177.7kJ·mol-1
②C(s) + H2O(g) =" CO(g)" + H2(g)ΔH=131.3kJ·mol-1
③1/2 H2SO4(aq) + NaOH(aq) =1/2Na2SO4(aq) + H2O(l)ΔH= —57.3kJ
④C(s) + O2(g) = CO2(g)ΔH=—393.5kJ·mol-1
⑤CO(g) + 1/2O2(g) = CO2(g)ΔH=—283kJ·mol-1
⑥HNO3(aq) + NaOH(aq) = NaNO3(aq) + H2O(l)ΔH=—57.3kJ·mol-1
(1)上述热化学方程式中,不正确的有;
(2)上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有。
某温度时,在10 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
2.00 |
0.00 |
| 1 |
0.90 |
1.80 |
0.20 |
| 3 |
0.75 |
1.50 |
0.50 |
| 5 |
0.65 |
1.30 |
0.70 |
| 9 |
0.55 |
1.10 |
0.90 |
| 10 |
0.55 |
1.10 |
0.90 |
| 14 |
0.55 |
1.10 |
0.90 |
(1) 体系中发生反应的化学方程式是____________;
(2) 计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3) 该反应达到平衡时反应物X的转化率α等于________;
(4) 如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1所对应的实验条件改变是:______ ______。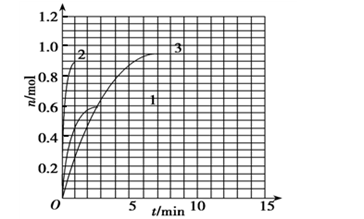
(5)如果起始加入X、Y、Z的物质的量分别为2.00 mol、4.00 mol和0 mol,在原温度下达平衡时,X的转化率为α!,则α! α(填 < > =)。
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00 mol、1.00 mol和1.00 mol,此时可逆反应的反应速率:u(正)u(逆)(填 < > =)。