化合物A(C8H17Br)经NaOH醇溶液处理后生成两种烯烃B1和B2。B2(C8H16)经过1.用臭氧处理,2.在Zn存在下水解,只生成一种化合物C。C经催化氢化吸收一摩尔氢气生成醇DC4H10O.,用浓硫酸处理D只生成一种无侧链的烯烃E(C4H8.)。已知: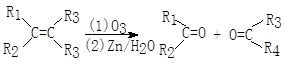
注:R1、R3可为H或其它烃基
试根据已知信息写出下列物质的结构简式:
A______________________B2_______________
C_____________________ E________________
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下。
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ,Ca(OH)2不能过量的原因是 。
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯。
制备苯甲酸苯酯的实验步骤为:
步骤1:将20mL浓H2SO4与40mL冰醋酸在下图装置的烧杯中控制在5℃以下混合。
步骤2:向烧杯中继续加入过硫酸钾25g,用电磁搅拌器搅拌4~5分钟,将二苯甲酮9.1g溶于三氯甲烷后,加到上述混合液中,控制温度不超过15℃,此时液体呈黄色。
步骤3:向黄色液体中加水,直至液体黄色消失,但加水量一般不超过1mL,室温搅拌5h。
步骤4:将反应后的混合液倒入冰水中,析出苯甲酸苯酯,抽滤产品,用无水乙醇洗涤,干燥
(1)步骤1中控制在5℃以下混合的原因为 。
(2)步骤2中为控制温度不超过15℃,向混合液中加入二苯甲酮的三氯甲烷溶液的方法是 。
(3)步骤3中加水不超过1mL,原因是 。
(4)步骤4中抽滤用到的漏斗名称为 。
(5)整个制备过程中液体混合物会出现褐色固体,原因是 ;除去该固体操作为 。
高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存在生活空间中的一些有害物质(甲醛、氮氧化物等)。
(1)Ti2+的基态价电子排布式为 。
(2)甲醛分子中C原子轨道杂化类型为 。1mol甲醛分子中含有σ键的数目为 。
(3)甲醛易溶于水,除因为它们都是极性分子外,还因为 。
(4)与N2O互为等电子体的一种分子为 (填化学式) 。
(5)某含钛化合物晶胞结构如图所示,该化合物的化学式为 。
氨气在生产、生活和科研中应用十分广泛
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)ΔH=+ 72.49 kJ·mol-1
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)ΔH= kJ·mol-1。
②液氨可以发生电离:2NH3(l) NH2- + NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式 。
NH2- + NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式 。
(2)氨气易液化,便于储运,可利用NH3作储氢材料
已知:2NH3(g) N2(g) + 3H2(g) ΔH=+92.4 kJ·mol-1
N2(g) + 3H2(g) ΔH=+92.4 kJ·mol-1
① 氨气自发分解的反应条件是 (填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如右图所示。
在600℃时催化效果最好的是 (填催化剂的化学式)。c点氨气的转化率高于b点,原因是 。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
①写出电解时A极的电极反应式: 。
②写出第二步反应的化学方程式: 。
葡萄酒常用Na2S2O5做抗氧化剂。
(1)1.90g Na2S2O5最多能还原 mLO2(标准状况)。
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。
写出Na2S2O5溶解于水的化学方程式 ;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是 。
已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤ mol·L-1。
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O=H2SO4+2HI):准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分。取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol·L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL。重复以上操作,消耗标准I2溶液15.98mL。计算葡萄酒样品中抗氧化剂的残留量 (单位:mg·L-1,以SO2计算,请给出计算过程。)