(8分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法l:还原沉淀法
该法的工艺流程为 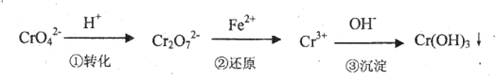
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
下图中每一方框中的字母代表一种反应物或生成物(部分产物未列出):
已知C是紫红色金属固体,B的浓溶液和稀溶液都是有强氧化性。
(1)A的化学式是,E化学式是;
(2)电解反应的化学(或离子)方程式是;
(3)对200ml 1mol/L的A溶液进行电解,当有0.02mol电子发生转移时,溶液的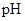 为
为
(假设溶液体积不变)。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化,据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2) 根据上述框图反应关系,写出下列B、D所含物质的化学式
根据上述框图反应关系,写出下列B、D所含物质的化学式
固体B;沉淀D
(3)写出①、②、两个反应的离子方程式
①
②
现有三种物质A、B、C,它们均溶于水。其中有一种是酸,一种是碱,一种是盐,溶于水后电离,可以产生下表中的离子:
| 阳离子 |
Na+H+Ba2+ |
| 阴离子 |
OH- CO SO SO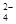 |
为鉴别它们,分别完成以下实验,其结果如下:
① A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
② B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝 酸。
酸。
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X
(2)B溶于水后的电离方程式为
(3)鉴别B中阴离子的实验操作方法是
(4)B与C反应的离子方程式:
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、D的化学式A______ D__________
(2)写出F和H反应的化学方程式
(3)写出下列反应的离子方程式:B+水
(4)要除掉D溶液中含有的少量C,最理想的方法 是(用化学方程式表示)。
是(用化学方程式表示)。
通常采用将钠与亚硝酸钠(NaNO2)在空气中共热的方法制取氧化钠,反应的另一产物为N2,则该反应的化学方程式为_______________,该反应的氧化剂是________,被氧化的元素是___________。