( 10 分)
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 2H2O+2PbSO4 ;
2H2O+2PbSO4 ;
镍镉碱性充电电池在放电时,其
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
⑴铅蓄电池在放电时的负极反应为 ,其在充电时阳极反应为 ;
⑵镍镉碱性充电电池在充电时的总反应的化学方程式为 ;
⑶上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的
主要原因可能是 ;
⑷如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4 mol。
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) ="=" 2NO2(g)ΔH= + 67.7kJ·mol-1
N2H4(g) + O2(g)="=" N2(g) + 2H2O(g)ΔH= - 534.0kJ·mol-1
2NO2(g)  N2O4(g)ΔH=" -" 52.7kJ·mol-1
N2O4(g)ΔH=" -" 52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为:;
(3)工业上可以用下列反应原理制备氨气:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g)ΔH= Q kJ·mol-1
4NH3(g)+3O2(g)ΔH= Q kJ·mol-1
①已知该反应的平衡常数K与温度的关系如图,则此反应的 Q 0 (填“>”“<”或“=”)。
②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为0.3mol/L,则用氧气表示的反应速率为。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v(N2)/v(O2)=2∶3 |
| C.容器中气体的密度不随时间而变化 |
| D.通入稀有气体能提高反应的速率 |
E.若向容器中继续加入N2,N2的转化率将增大
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)c(NO3-)(填“>”“<”或“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为。
某烃的含氧衍生物A能发生如下图所示的变化。已知A的蒸气密度是相同条件下H2的88倍,C的所有碳原子在同一平面上,J分子中所有碳原子在一条直线上,H遇FeCl3溶液显紫色。
(1)A分子中含有的官能团有。
A→B+C的反应方程式为。
(2)写出由B生成H的反应方程式为。
(3)由D生成(C4H6O2)n的反应类型为。由G到J的反应类型为。
(4)G的结构简式为,
(5)A的同分异构体甚多,满足下列条件的A的所有同分异构体有种(不考虑立体异构)。
①含苯环;②含羧基;③含醛基;④含碳碳双键。
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
① 基态Fe3+的M层电子排布式为。
② 尿素(H2NCONH2)分子中C、N原子的杂化方式分别是、;
③ 配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于(填晶体类型)
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=cm。 (用含ρ、NA的计算式表示)
(3)下列说法正确的是_。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
① 图中d单质的晶体堆积方式类型是。
② 单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含个σ键,个π键。
③ 图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:。
【化学——选修2化学与技术】
由Ca3(PO4)2、SiO2、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。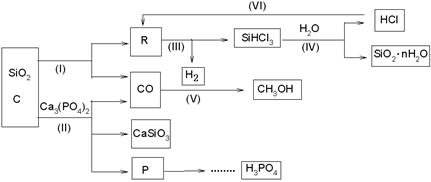
(1)上述反应中,属于置换反应的是[选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]
(2)高温下进行的反应Ⅱ的化学方程式为: ;
固体废弃物CaSiO3可用于 。
(3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是。
(4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为。
(5)指出(VI)这一环节在工业生产上的意义
(6)写出由P→H3PO4有关反应式
①
②
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示: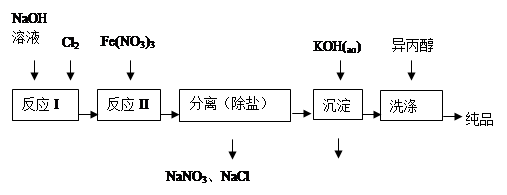
①洗涤粗品时选用异丙醇而不用水的理由是:。
②反应II的离子方程式为。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为它能净水的原因是。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是:。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠(填“大”或“小”)。
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式:。