甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题: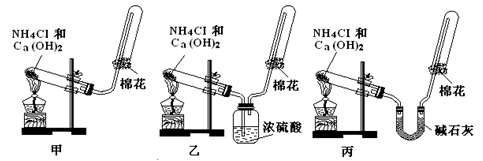
(1)三位同学制取氨气的化学方程式为:
_____________________________________________。
(2)三位同学都用向下排空气法收集氨气,其原因是____________________________.
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(如果他们的实验操作都正确),你认为没有收集到氨气的同学是___________填(“甲”、“乙”或“丙”),收集不到氨气的主要原因是_____________________________________(用化学方程式表示)。
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是_________(填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替制备NH3?____________(填“能”或“不能”)。
由A、B、C、D四种金属按下表中装置进行实验,已知用C与B相连作电极放入硫酸铜溶液中B溶解。根据实验现象填表:
| 装置 |
 |
 |
 |
| 现象 |
金属A断溶解 |
C的质量增加 |
A上有气体产生 |
| 正极反应式 |
|||
| 四种金属活动性有强到弱的顺序: |
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
①哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,原因是
。
②哪一段时段的反应速率最小,原因是。
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A 蒸馏水、 B NaCl溶液、 C NaNO3溶液、 D CuSO4溶液、 E Na2CO3溶液,你认为可行的是。(填字母序号)
以下是实验室制取氯气的装置,在图中饱和食盐水的作用是_____________,
浓硫酸的作用是____________________,F中盛放的溶液是__________________________,
起的作用是_____________________________。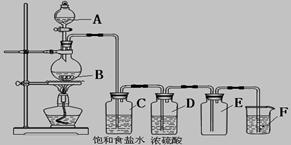
为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中。
| 实验要求 |
化学试剂 |
| 1.检验酒精中是否有水 |
|
| 2.区别CH4和C2H4两种无色气体 |
|
| 3.验证味精是否有食盐 |
|
| 4.除去Fe2O3中的Al2O3 |
供选择的化学试剂:
A.酸性高锰酸钾B.硝酸银溶液和硝酸C.氢氧化钠溶液D.无水硫酸铜粉末
欲用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液480mL。试回答下列问题:
(1)你所需要量取的浓硫酸的体积为mL。
(2)除下图中仪器①②外,本实验还需要用到的玻璃仪器有:胶头滴管、、。
下图是某同学转移溶液的示意图,请改正图中的错误:。
(3)配制过程中,造成浓度偏高的操作可能有(填序号)。
| A.容量瓶用蒸馏水洗后未干燥 |
| B.量筒用蒸馏水洗后未干燥 |
| C.未用水洗涤溶解过浓硫酸的烧杯 |
| D.用量筒量取浓硫酸时,俯视读数 |
E.定容时,俯视液面加水至刻度线
F.向容量瓶中转移浓溶液时不慎有液滴掉在容量瓶外面
G.将烧杯中溶解后的溶液立即转移入容量瓶,然后再加蒸馏水至刻度线
H.用胶头滴管向容量瓶中加水时,不慎超过刻度线,又用胶头滴管从容量瓶中吸出部分溶液,使液面的最低点刚好与刻度线相切