某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
| A.1 mol该有机物在加热和催化剂作用下,最多能和4 mol H2反应 |
| B.该有机物能使溴水褪色也能使酸性KMnO4溶液褪色 |
| C.该有机物遇硝酸银溶液产生白色沉淀 |
| D.该有机物在一定条件下,能发生消去反应或取代反应 |
下列陈述正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
SO2有漂白性 |
SO2可使溴水褪色 |
| B |
SiO2有导电性 |
SiO2可用于制备光导纤维 |
| C |
浓硫酸有强氧化性 |
浓硫酸可用于干燥H2和CO |
| D |
Fe3+有强氧化性 |
FeCl3溶液可用于回收废旧电路板中的铜 |
下列各图所示实验设计能达到相应实验目的的是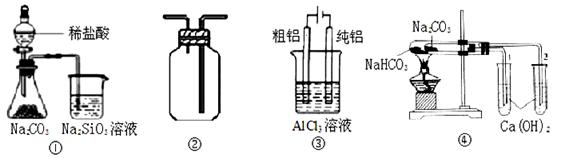
| A.用图①装置验证氯、碳、硅元素非金属性 |
| B.用图②装置能收集O2、CO2和H2 |
| C.用图③装置电解精炼铝 |
| D.用图④装置验证NaHCO3和Na2CO3的热稳定性 |
将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。以下推测肯定不正确的是
| A.①中红色褪去的原因是KMnO4将SCN-氧化 |
| B.②中红色褪去的原因是SO2将Fe3+还原成Fe2+ |
| C.②中红色褪去的原因是SO2将SCN-还原 |
| D.SCN-在适当条件下可失去电子被氧化为(SCN)2 |
下列离子方程式正确的是
| A.向次氯酸钙溶液通入SO2:Ca2++2ClO−+SO2+H2O=CaSO3↓+2HClO |
| B.向NH4A1(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全 NH4++Al3++2Ba2++2SO42-+4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| C.向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
| D.向硝酸银溶液中滴加稀氨水至过量:Ag+ + NH3•H2O=AgOH↓ + NH4+ |
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3 + 3KClO + 4KOH=2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
| A.制备高铁酸钾用ClO−做还原剂 |
| B.制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子 |
| C.高铁酸钾中铁的化合价为+7 |
| D.用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体 |