已知:A、B、D为中学常见的单质,只有一种是金属,对应的元素均处在周期表中的短周期;甲、乙、丙、丁、戊、己为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,分子中不同原子的个数比为1:2,各原子最外层电子都达到稳定结构;乙是一种耐火材料;己是一种无色气体。
各物质间的转化关系如下图所示(某些条件已略去)。
请回答:
(1)单质B的组成元素在周期表中的位置是 。
(2)丁的电子式为 。
(3)反应①的化学方程式为 。
(4)丁的燃烧产物对环境无污染。丁—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入丁的电极反应式是:
,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(5)反应②中,0.5 mol NaClO参加反应时,转移1mol 电子,其化学方程式为:
。
(6)标准状况下用排水法收集满一烧瓶己(水蒸气不计),塞上带导管的橡皮塞,通过导管向其中缓慢通入氧气,现象是: ,一段时间后,常压下不能再通入氧气,则将烧瓶倒立,导管插入盛水的水槽中,用粘冰水的毛巾冷却烧瓶,即看到烧瓶中出现“喷泉”,“喷泉”结束时,瓶中溶液的物质的量浓度是: 。(精确到小数点后三位)
现有①NaCl②金刚石 ③Na ④NaHSO4⑤干冰 ⑥碘片六种物质,按要求回答下列问题(填序号):
(1)属于离子化合物的是,只有离子键的物质是,晶体以分子间作用力结合的是。
(2)NaHSO4熔融状态下电离,破坏了键,写出电离方程式
(3)判断①、②、③、⑤熔沸点高低顺序
将下列物质进行分类(填序号)
①O2与O3
②126C与136C
③白磷与红磷
④冰与水
⑤H2、D2、T2
⑥乙醇与二甲醚
⑦ 和
和 
(1)互为同位素的是
(2)互为同素异形体的是
(3)互为同分异构体的是
(4)属于同一化合物的是
将等物质的量的A、B混合于2L密闭容器中发生如下反应:3A(g)+B(g)=xC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5, C的平均反应速率是0.1mol/(L.min)求:
(1)此时A的浓度为,反应开始前容器中B的物质的量为。
(2)B的平均反应速率为。
(3)x=。
乙烯是重要的有机化工原料。
(1)实验室中,乙烯可由乙醇脱水制得。工业上,乙烯的获取主要来自于石油的。
(2)将乙烯通入溴水中,可以观察到溴水褪色,请写出反应的化学方程式并注明反应类型:,反应类型为。
(3)下列物质与乙烯催化加氢得到的产物互为同系物的是(选填编号)。
a.C2H6 b.C3H6 c.C3H8 d.C4H8
(4)水果保鲜时常使用浸泡过高锰酸钾溶液的硅藻土,其原因是。
Ⅰ.对于4FeS2+11O2 ==2Fe2O3+8SO2,试回答有关的问题:
(1)常选用哪些物质浓度的变化来表示该反应的速率;
(2)为了提高生成SO2的速率,可以采取的措施是;
A.增加FeS2的量 B.增大O2的浓度 C.升高温度 D.减小压强
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如下图所示(A,B,C均为气体)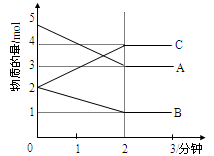
(3)该反应的化学方程式为;
(4)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是(填字母)
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2∶1∶2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化