已知2X2(g)+Y2(g) 2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
(1)此反应平衡常数表达式为____________________;若将温度降低到300℃,则反应平衡常数将______________(填增大、减少或不变)。
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度___________Wmol·L-1(填“>”、“<”或“=”),a,b、c之间满足关系___________(用代数式表示)。
(3)能说明反应已达平衡状态的是_____________________(从下列选项中选择)。
a.浓度c(Z)=2c(Y2) b.容器内压强保持不变
c.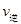 (X2)=2
(X2)=2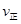 (Y2) d.容器内的密度保持不变
(Y2) d.容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和lmol Y2达到平衡后,Y2的转化率将___________(填“变大”、“变小”或“不变”)。
(1)用水稀释0.1mol/L氨水,溶液中随着水量的增加而减小的是_______(填字母)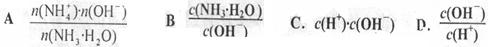
(2)已知25℃时,Ksp(CaSO4)==7.10×10-5.向0.100L含CaSO4固体的溶液中加入2.22gCaCl2粉末充分搅拌,若溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将______ (填“增大”、“减小”或“不变”,下同), Ksp(CaSO 4)将________。
4)将________。
硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2 SO2 (g)+ O2(g) 2 SO3(g)△H =" —196.0" kJ.mol-1
2 SO3(g)△H =" —196.0" kJ.mol-1
①容器体积不变时,为了提高SO2的转化率,可采用的措施是_____(填字母标号)。
| A.加入V2O5做催化剂 | B. 使用过量SO2 使用过量SO2 |
C.高温 | D.通入过量空气 |
②某温度时,在一个容积为10L的密闭容器中充入4.0mol SO2和2.0molO2,半分钟后达到平衡,并放出352.8 kJ的热量。此时SO2的转化率是_____,该温度下的平衡常数K===_____________。(每空3分)
在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l) 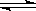 4NH3(g)+3O2(g) △H =" a" kJ.mol-1
4NH3(g)+3O2(g) △H =" a" kJ.mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下:
| 温度T/K |
303 |
313 |
323 |
| NH3生成量/(10—6mol) |
4.8 |
5.9 |
6.0 |
①该反应的a______0(填“>”、“<”或“=”)
②已知:N2(g)+3H2( g)
g) 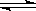 3NH3(g) △H =" —92.4" kJ.mol-1
3NH3(g) △H =" —92.4" kJ.mol-1
2H2(g) + O2(g)==2H2O(l)△H =" —571.6" kJ.mol-1
则 2N2(g) + 6H2O(l)
2N2(g) + 6H2O(l) 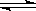 4NH3(g) + 3O2(g)△H = _________。
4NH3(g) + 3O2(g)△H = _________。
某温度(t°C)时,测得0.0 1mol·L-1的NaOH溶液的pH为11,则该温度下水的Kw= .
1mol·L-1的NaOH溶液的pH为11,则该温度下水的Kw= .
在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合.
(1)若所得混合液为中性,且a=2,b=12,则Va∶Vb= ;
(2)若所得混合液的pH=10,且a=2,b=12,则Va∶Vb= 。
在2L的密闭容器中,加入2molA和1molB,发生下述反应:
2A(g)+B(g) 2C(g)+D(s),达到平衡时,C的浓度为0.4mol·L-1。
2C(g)+D(s),达到平衡时,C的浓度为0.4mol·L-1。
(1)温度不变,若缩小容器体积,则平衡移动(填“正向”、“逆向”、“不”)。
(2)维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是0.4mol·L-1的是。
| A.4molA+2molB | B.2molC+1molD |
| C.2molA+1molB+2molC+1molD | D.1molA+0.5molB+1molC+0.5molD |