已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4⇋ 2H2O+2PbSO4;镍镉碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
(1)铅蓄电池在放电时的负极反应为 ,其在充电时阳极反应为 ;
(2)镍镉碱性充电电池在充电时的总反应的化学方程式为 ;
(3)上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是 ;
(4)如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4 mol。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a; X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: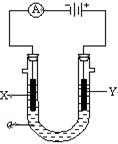
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则在X极附近观察到的实验现象是 ;Y电极上的电极反应式为 。若电解过程转移的电子为0.2mol,则X电极上产生的气体体积是 L(标准状况下)。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4 溶液,则X电极的材料是 ;Y电极的电极反应式为 。(说明:杂质发生的电极反应不必写出)
某兴趣小组采用如下方法制作氢氧燃料电池。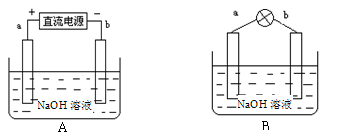
(1)如图A所示:a、b均为多孔石墨棒(多孔石墨棒,可吸附并储存生成的气体),其中a与直流电源正极相连,b与直流电源负极相连,电解质溶液为NaOH溶液,则a电极上发生的电极反应式为_______________,电解后溶液的浓度 ____________(填“增大”、“减小”或“不变”)。
(2)然后如图B所示,移走直流电源,在a、b极间连接一个发光二极管,可以看到二极管发光。此时的电流方向是______________(填“a→b”或“b→a”),b极的电极反应式为________________________。
依据氧化还原反应:Zn(s) + Cu2+(aq) ="=" Zn2+(aq)+ Cu(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是_________ ;电解质溶液Y是_________ ;
(2)铜电极为电池的________极,发生的电极反应为____________ ____ ;X电极上发生的电极反应为______________________。
1gC2H2完全燃烧生成液态水和CO2,放出49.8kJ热量,则2molC2H2完全燃烧放出的热量为 kJ;写出C2H2燃烧的热化学方程式: 。
为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格。
| 实验目的 |
试剂及方法 |
| 证明地瓜中有淀粉 |
|
| 除去CO2中混有的少量CO |
|
| 检验FeCl2溶液是否变质 |
|
| 除去Na2CO3固体中NaHCO3 |
供选择的化学试剂及实验方法
A.加热 B.滴加碘水
C.加入KSCN溶液 D.通过灼热的CuO