A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这种三元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A ,D ,E 。
(2) B、F形成的化合物的电子式 。
(3)A、F两种元素最高价氧化物的水化物之间反应的离子方程式 。
(8分)(1)3.01×1022个OH-的物质的量为质量为,这些OH-与mol NH3的质量相等,与g Na+含有的离子数相同;
⑵将4.6 g 金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与水反应能够放出标准状
金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与水反应能够放出标准状
况下的气体L,实验后所得溶液中Na+的物质的量为;
⑶同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量之比为原子个数之比。
500mL某浓度的NaOH溶液恰好与标准状况下11.2LCO2完全反应生成正盐,则
①原溶液中NaOH的物质的量浓度为,
②若在原溶液中通入16.8L(标准状况下)CO2则生成的产物是 。
。
③若在②中的产物中加足量的盐酸,则需要盐酸的物质的量为。
甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题: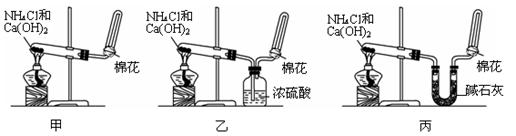
(1)三位同学制取氨气的化学方程式为:_______________________
(2)三位同学都用向下排空气法收集氨气,而不用排水法,其原因是_________
A、氨气难溶于水 B、氨气极易溶于水
B、氨气极易溶于水
C、氨气密度比空气大 D、氨气密度比空气小
E、氨气密度比水大 F、氨气密度比水小
(3)三位同学用上述装置制取氨气时,其中乙同学没有收集到氨气,收集不到氨气的主要原因是____________________ (用化学方程式表示)。
(4)检验氨气是否收集满的方法是_________
A、闻到有氨气逸出
B、棉花被气体冲出
C、用湿润的红色石蕊试纸在试管口检验,发现试纸变蓝
D、用湿润的蓝色石蕊试纸在试管口检验,发现试纸变红
(5)三位同学都认为他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断能够达到实验目的的是___________(填“甲”、“乙”或“丙”)。
现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素。请回答下列问题: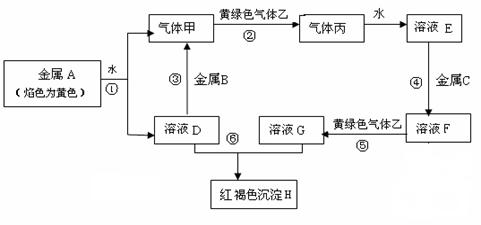
(1)写出金属B和气体丙的化学式、 。
。
(2)写出反应①的化学反应方程式。
写出反应⑥的离子方程式。
有A、B、C、D四种盐,组成它们的阳离子有:Ba2+、Ag+、N a+、Cu2+中,阴离子有:NO3-、Cl-、SO42-、CO32-。某同学设计实验对它们进行鉴别:
a+、Cu2+中,阴离子有:NO3-、Cl-、SO42-、CO32-。某同学设计实验对它们进行鉴别:
⑴把四种盐分别溶解于盛有蒸馏水的四支试管中,均得到澄清溶液。通过观察及分析,该同学得出如下结论:呈蓝色的溶液可以确定是A,则A为:(填化学式);
⑵再向未确定的三支试管中分别加入盐酸,则B盐溶液有沉淀产生,C盐溶液有无色无味气体产生。该同学确定另三种盐的化学式分别为:
B,C,D。(填化学式)
⑶请你帮该同学完成下列反应的离子方程式:
B+盐酸:
C+盐酸:
A与D混合: